
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A 铁 B 铝 C 铂 D 玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
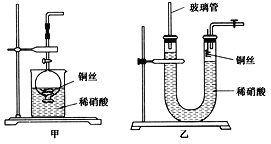
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置,
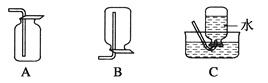
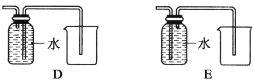
合理的是________(填选项代号)。
【答案】3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ C、D 2NO+O2=2NO2 接收被气体压出U形管的液体,防止稀硝酸溢出 关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止 C、D
【解析】
(1)Cu与硝酸反应生成硝酸铜、NO和水,据此书写离子方程式;
(2)①实验的目的是证明金属铜和硝酸之间的反应,右侧选择所用的材料不能与稀硝酸反应;②图1中试管内有空气,结合NO的性质分析解答;
(3)根据一氧化氮的溶解性,结合装置的特点分析解答;
(4)根据一氧化氮的溶解性与化学性质确定收集方法。
(1)金属铜可以和稀硝酸反应生成硝酸铜、一氧化氮以及水,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①实验室若没有铜丝,以铜粒代替铜丝进行实验,则包裹铜粒的材料不能与稀硝酸反应,不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸发生反应,故答案为:CD;
②试管内有空气,NO容易被氧化为红棕色的二氧化氮气体,即2NO+O2═2NO2,故答案为:2NO+O2═2NO2;
(3)①一氧化氮是难溶于水的气体,当右侧产生一氧化氮气体时,气体把U形管的液体压向左侧,长玻璃管可以防止稀硝酸溢出,故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②让反应停止,则应该使铜和稀硝酸分开,具体操作方法及原因为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右侧管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,故答案为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)由于一氧化氮与氧气在常温下容易反应生成二氧化氮,故不能用排空法收集,所以只能用排水法,故C正确,而D和E装置,应该短进长出,所以D正确,E错误,故答案为:CD。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )
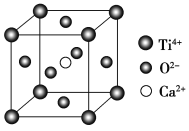
(CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A. 它难溶于水,但易溶于苯
B. 该物质含苯环的同分异构体(不包括它本身)共有5种
C. 它会使酸性高锰酸钾溶液褪色
D. 一定条件下以和浓硝酸、浓硫酸的混合物发生硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】再生铅行业是我国在重视环境保护和充分利用有色金属再生资源的情况下逐步发展起来的新兴产业。从废旧铅蓄电池中回收铅的工艺为:
![]()
电解原理如图所示。下列说法正确的是
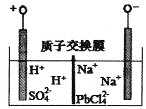
A. 阴极区电极反应式为:2H++2e-=H2↑
B. 电解过程中阳极附近pH明显增大
C. Na2PbCl4浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
D. 电路中流经4mol电子,阴极可得207g铅
查看答案和解析>>
科目:高中化学 来源: 题型:
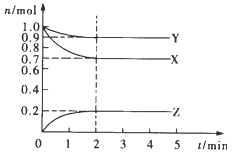
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气态物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为_________。反应开始至2 min,Z的平均反应速率为__________。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= -1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式___________________________________________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式),生成该沉淀的离子方程式为__________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)Na2S溶液具有较强的碱性,其原因为______________________。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A、B是金属单质,E、K是非金属单质,其它为化合物,F、G、H、I、J 焰色反应均为黄色,在这些物质中只有C、K是气体,其中K是黄绿色气体,反应⑧⑨是工业由H制I的重要反应。
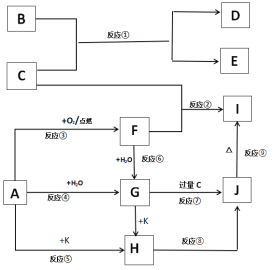
填写下列空白:
(1)写出化学式:B___,F___。
(2)写出反应①的化学反应方程式:____。
(3)写出反应⑦离子反应方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 用核磁共振氢谱能鉴别1-氯丙烷和2-氯丙烷
B. ![]() 和
和![]() 分子组成相差一个“-CH2-”,因此是同系物
分子组成相差一个“-CH2-”,因此是同系物
C. ![]() 和
和![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
D. 分子式为C3H6有机物最多存在4个C-C单键,与C5H12的碳碳单键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
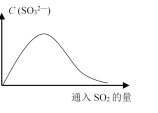
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:C2H5CH=CHCH3+CH2=CH2![]() C2H5CH=CH2+CH2=CHCH3
C2H5CH=CH2+CH2=CHCH3
现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:

(1)按系统命名法,有机物A的名称是_______。
(2)B的结构简式是__________。
(3)C![]() D的反应类型是___________。
D的反应类型是___________。
(4)写出D![]() M的化学方程式________。
M的化学方程式________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_______。
(6)满足下列条件的X的同分异构体共有_______种,写出任意一种的结构简式_________。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
(7)写出E![]() F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com