
【题目】下列关于晶体的说法一定正确的是( )
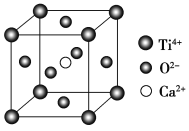
(CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 比较金属镁和铝的活泼性 | 分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象 |
B | 除去Mg粉中混有的Al 粉 | 加入足量的NaOH 溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类化合物在维生素C的作用下能够转化为有毒的+3价的含砷化合物。通过以上信息填空:上述过程中+5价砷类物质作为______(填氧化剂或还原剂),+5价砷元素发生______反应(填氧化或还原);0.5mol+5价砷完全转化为+3价砷,共转移______个电子。
(2)实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
①用双线桥标出电子转移方向和数目______;(在答题纸上标)
②在标准状况下生成的氯气为11.2L时,被氧化的HCl的质量为______;
③为保证实验安全,常用氢氧化钠溶液吸收多余的氯气,写出反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将CO2转化成甲醇燃料是减排、环保的一种科学方法。
已知:2H2(g)+O2(g) =2H2O(g);△H=-483.6kJ·mol-1 ①
2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
则用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为___________________
II.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。

试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为____________。
(2)能判断该反应达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中c(A)不变
c.2v正(B)=v逆(D) d.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=________,该反应为_______反应(填吸热或放热),判断理由是______________________________。
(4)800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国很早就使用青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
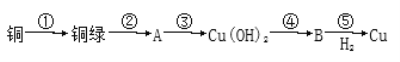
(1)从物质分类标准看,“铜绿”属于___(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)请写出铜绿与盐酸反应的离子方程式:___。
(3)上述转化过程中属于氧化还原反应的是___(填序号)
(4)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨是富氢物质,是氢能的理想载体。下列说法不正确的是( )
A. NH3分子中氮原子的杂化方式为sp3杂化
B. [Cu(NH3)4]2+中,NH3分子是配体
C. NH![]() 与PH
与PH![]() 、CH4、BH
、CH4、BH![]() 互为等电子体
互为等电子体
D. 相同压强下,NH3的沸点比PH3的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.CaO+H2O=Ca(OH)2
C.WO3+3H2![]() W+3H2O
W+3H2O
D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六苯乙烷为无色晶体,其结构如图所示。下列有关说法中正确的是( )
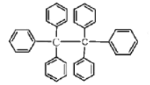
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 核磁共振氢谱有3组峰
D. 它的分子中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A 铁 B 铝 C 铂 D 玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
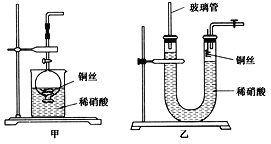
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置,
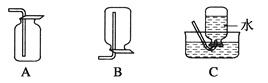
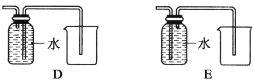
合理的是________(填选项代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com