
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
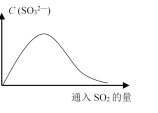
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
【答案】SO2中+4价的S ![]() ab
ab ![]() mol/(L·min) 通入NO2、移走NO或SO3、降低温度、通入O2等(任写两种) 2H2SO3 +O2=2H2SO4 SO2与OH-反应生成SO32-,因此SO32-浓度增大;继续通入SO2时,SO2与SO32-反应生成HSO32-,导致SO32-浓度减小
mol/(L·min) 通入NO2、移走NO或SO3、降低温度、通入O2等(任写两种) 2H2SO3 +O2=2H2SO4 SO2与OH-反应生成SO32-,因此SO32-浓度增大;继续通入SO2时,SO2与SO32-反应生成HSO32-,导致SO32-浓度减小
【解析】
(1)氧化还原反应中所含元素化合价升高被氧化、化合价降低被还原;化学反应的平衡常数K=![]() ;
;
(2)平衡标志是用同一物质表示的正、逆反应速率相同,各成分浓度保持不变;
(3)同一反应,不同反应物或生成物的速率之比等于化学计量数之比,且v=![]() ;
;
(4)可结合影响平衡的因素分析,通过改变影响平衡的条件,促进平衡正向移动,提高SO2的转化率;
(5)亚硫酸具有较强还原性,易被空气中的氧气氧化生成硫酸,硫酸为强酸,由此分析放置亚硫酸pH变小的原因;
(6)SO2溶于NaOH溶液生成Na2SO3,随着反应的进行,溶液中SO32-增大,当NaOH完全反应后,继续通入SO2,Na2SO3会与SO2反应生成NaHSO3,溶液中SO32-浓度降低。
(1)反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)中S元素化合价从反应前SO2的+4升高为SO3的+6,被氧化;根据平衡常数的含义可知此反应的平衡常数表达式:K=
SO3(g)+NO(g)中S元素化合价从反应前SO2的+4升高为SO3的+6,被氧化;根据平衡常数的含义可知此反应的平衡常数表达式:K=![]() ;
;
(2)a.平衡混合物中只有NO2是红棕色的气体,其它气体均无色,若混合气体颜色保持不变, 则NO2浓度不变,证明反应达到平衡状态,a正确;
b.在反应过程中NO2和NO的体积之比为变量,则当NO2和NO的体积之比保持不变,能说明反应达到平衡,b正确;
c.每消耗1mol SO2的同时生成1mol SO3,说明反应正向进行,不能证明反应达到平衡,c错误;
d.反应前后气体质量不变,气体的体积不变,则反应过程中体系的气体密度始终不变,因此体系气体密度不变不能证明反应达到平衡,d错误;
故合理选项是ab;
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(SO2)=![]() mol/(L·min);
mol/(L·min);
(4)此反应的正反应为吸热反应,根据平衡移动原理,通入NO2、移或通入O2、走NO或SO3、降低温度均能促进平衡正向移动,达到提高SO2的转化率目的;
(5)亚硫酸为弱酸,但其还原性较强,易被空气中氧化氧化,发生2H2SO3+O2=2H2SO4,生成的硫酸为强酸,强酸完全电离产生自由移动的离子,因此可使溶液酸性增强,使pH减小;
(6)在NaOH溶液中不断通SO2,开始时SO2与OH-反应生成SO32-,使溶液中SO32-浓度增大;随着反应的进行,当通入SO2过量时,H2O、SO2与SO32-反应生成HSO3-,导致SO32-浓度又逐渐减小。


科目:高中化学 来源: 题型:
【题目】六苯乙烷为无色晶体,其结构如图所示。下列有关说法中正确的是( )
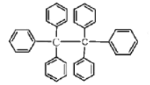
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 核磁共振氢谱有3组峰
D. 它的分子中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A 铁 B 铝 C 铂 D 玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
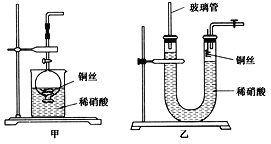
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置,
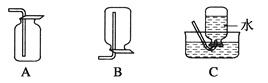
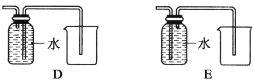
合理的是________(填选项代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)3.01×1023个H2O的物质的量为________mol,其中,所有原子的物质的量为________mol,所含电子的物质的量为________mol。
(3)1.204×1023个![]() 的物质的量为________mol,质量为________g。
的物质的量为________mol,质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2=2KCl+I2,碘与溴一样易溶于有机溶剂):
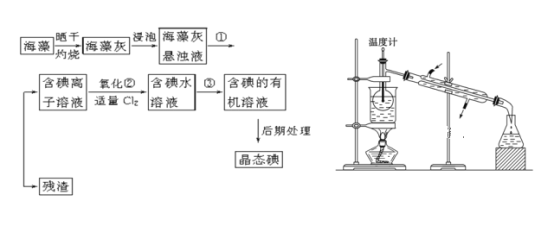
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A 苯 B 四氯化碳 C 酒精 D 醋酸
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是___________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①__________。②_____________。③_________。
(5)进行上述蒸馏操作时使用水浴的原因是__________。
(6)如果本实验用苯做萃取剂,则上层液体的颜色为_______色,下层液体中溶质的主要成分为___________(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(主要含BeO、CuS,还含少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
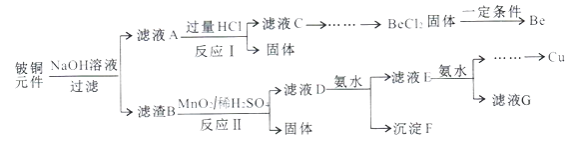
已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:
(1)滤液A的主要成分除NaOH外,还有___________(填化学式);写出反应I中含铍化合物与过量盐酸反应的离子方程式:___________。
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是___________;电解熔融BeCl2制备金属铍时,需要加入NaCl,其作用是___________。
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为___________。
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是________(填化学式);为了尽可能多的回收铜,所得滤液G的pH最大值为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的下列说法中,不正确的是( )
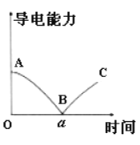
A.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
C.BC段溶液的导电能力不断增大,主要是由于过量的H2SO4电离出的离子导电
D.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4>O2
D.如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com