
��һ�ܱպ��ݵ������У����淴Ӧ3A(g) 3B(��)��C(��)�������仯��ͼ����ʾ�������ƽ����Է���������ʱ��ı仯��ͼ����ʾ��
3B(��)��C(��)�������仯��ͼ����ʾ�������ƽ����Է���������ʱ��ı仯��ͼ����ʾ��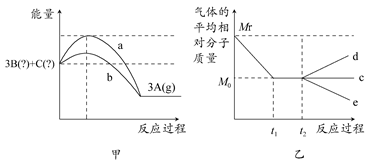
(1)��ͼ�����ж�3A(g) 3B(��)��C(��)������Ӧ��________��Ӧ(����ȡ����ȡ�)��ʵ��a��ʵ��b��Ƚϣ����������ķ�Ӧ������________��
3B(��)��C(��)������Ӧ��________��Ӧ(����ȡ����ȡ�)��ʵ��a��ʵ��b��Ƚϣ����������ķ�Ӧ������________��
(2)��ͼ�ҿ��Եó��й�B��C״̬�Ľ�����________��
����t2ʱ�������¶ȣ������ƽ����Է��������仯һ������________��(�c����d����e��)��
�����ı�ѹǿ�������ƽ����Է��������仯һ������c�ߣ���C���ʵ�״̬Ϊ________��
(3)���ƽ����¶Ȳ��䣬�������������һ������ƽ��ʱA��Ũ����ԭ����60%����B��________״̬��C��________״̬��
(4)���BΪ���壬CΪ���壬ȡ0.3 mol A��������1 L�����г�ַ�Ӧ��ƽ��ʱ���B��Ũ��Ϊ0.21 mol/L����ʹ��Ӧ���淴Ӧ��ʼ����ʼʱ�������м���0.3 mol B��ͬ�������£�Ҫʹƽ��ʱB��Ũ����Ϊ0.21 mol/L����C�����ʵ�����ȡֵ��ΧӦ����________��
 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������;ʮ�ֹ㷺����ҵ�Ϻϳ�����ʱ����SO2ת��Ϊ��������һ���ؼ����衣��ش��������⣺
��1���÷�Ӧ�ں��º����ܱ������н��У��ж���ﵽƽ��״̬�ı�־��������������ĸ��
a��SO2��SO3Ũ�����
b��SO2�ٷֺ������ֲ���
c�������������ѹǿ����
d��SO3������������SO2�������������
e�������л��������ܶȱ��ֲ���
��2��ij�¶��£�2SO2(g)��O2(g�� 2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
��3��һ���¶�ʱ��SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ���Է�����ҵ�����в��ó�ѹ��ԭ������ ����
��4����һ������SO2��0.7 molO2����һ��������ܱ������У���550��ʹ��������·�����Ӧ����Ӧ�ﵽƽ��������еĻ������ͨ������NaOH��Һ���������������21.28 L���ٽ�ʣ������ͨ������ûʳ����ļ�����Һ����O2�����������ּ�����5.6 L(�������������Ϊ��״���µ����)����÷�Ӧ�ﵽƽ��ʱSO2��ת�����Ƕ��٣���Ҫд��������̣�����������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���ͨ����ú�������������ɵ�CO��H2��һ�������£��������·�Ӧ�Ƶã�CO(g)��2H2(g)  CH3OH(g)�������ͼʾ�ش��������⣺
CH3OH(g)�������ͼʾ�ش��������⣺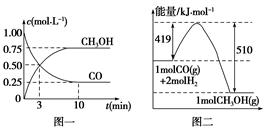
(1)�ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)�� ��CO��ת����Ϊ ��
(2)�÷�Ӧ��ƽ�ⳣ������ʽΪ ���¶����ߣ�ƽ�ⳣ�� (���������С�����䡱)��
(3)����һ����ɱ���ܱ������г���1 mol CO��2 mol H2��1 mol CH3OH���ﵽƽ��ʱ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6�������������ʺ�÷�Ӧ�� (����������桱)��Ӧ�����ƶ��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�¶�ʱ��2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ�����
��1���÷�Ӧ�Ļ�ѧ����ʽΪ��
��2����Ӧ��ʼ��2min����X��ʾ��ƽ����Ӧ����Ϊ��
��3������������˵��������Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ��
A���������������ʵ�������ʱ��ı仯���仯
B����λʱ����ÿ����3mol X��ͬʱ����2mol Z
C��������������������ʱ��ı仯���仯
��4�����ܱ������ͨ��a mol X(g)��b mol Y(g)��������ӦX(g��+ Y(g��=2Z(g)�����ı���������ʱ����Ӧ���ʻᷢ��ʲô�仯��ѡ������� ��С�� ���䡱��
�� �����¶ȣ�
�ڱ���������������䣬����X(g)�����ʵ�����
�� ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��10 mol A��5 mol B�����ݻ�Ϊ10 L���ܱ�������,ij�¶��·�����Ӧ:3A(g)+B(g) 2C(g),�����2 s��,����A��ƽ������Ϊ0.06 mol��L-1��s-1,����2 sʱ,�������� mol A,��ʱC�����ʵ���Ũ��Ϊ ��
2C(g),�����2 s��,����A��ƽ������Ϊ0.06 mol��L-1��s-1,����2 sʱ,�������� mol A,��ʱC�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��0.1 mol MnO2��ĩ��50 mL��������(H2O2���ѣ�1.1 g�� mL��1)�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ��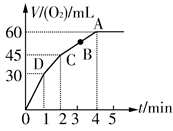
(1)ʵ��ʱ�ų�������������_____________________________��
(2)�ų�һ����������ʱ��Ϊ_______________________________��
(3)��Ӧ�ų������������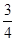 �����ʱ��ԼΪ__________________
�����ʱ��ԼΪ__________________
(4)A��B��C��D���㷴Ӧ���ʿ�����˳��Ϊ____________________
(5)���ͷ�Ӧ���ʱ仯��ԭ��___________________________________________________
(6)����H2O2�ij�ʼ���ʵ���Ũ��____________________
(7)��Ӧ��2 minʱ��H2O2����������_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪��O2 (g)= O2�� (g)+e�� ��H1=" +1175.7" kJ��mol��1
PtF6(g)+ e��= PtF6��(g) ��H2=" -" 771.1 kJ��mol��1
O2+PtF6��(s)=O2+(g)+PtF6�� (g) ��H3="+482.2" kJ��mol��1
��Ӧ��O2��g��+ PtF6 (g) = O2+PtF6(s)�ġ�H="_____" kJ��mol-1��
��ͼΪ�ϳɰ���Ӧ��ʹ����ͬ�Ĵ�������ͬ�¶Ⱥ�ѹǿ�����½��з� Ӧ����ʼʱN2��H2�������Ϊ1:3ʱ��ƽ�������а������������
�� ��һ�����¶��£������������ܱ������г��뵪������������������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵ��ѹǿ���ֲ��� b�����������ܶȱ��ֲ���
c��N2��H2�������Ϊ1:3 d����������ƽ��Ħ����������
�ڷֱ���vA��NH3����vB��NH3����ʾ�ӷ�Ӧ��ʼ��ƽ��״̬A��Bʱ�ķ�Ӧ���ʣ���vA��NH3�� vB��NH3�����>������<����=�������÷�Ӧ�ĵ�ƽ�ⳣ��kA kB���>������<����=��������250 �桢1.0��104kPa�´ﵽƽ�⣬H2��ת����Ϊ %������������С�����һλ����
��3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�ԭ�� �������ӷ���ʽ��ʾ���������Һ�м���bL��ˮ����Һ�����ԣ������Ӱ�ˮ��Ũ��Ϊ mol/L���ú�a��b�Ĵ���ʽ��ʾ��NH3��H2O�ĵ���ƽ�ⳣ��ΪKb=2��10-5��
��4����ͼ��ʾ��װ�â�Ϊ����ȼ�ϵ�أ��������ҺΪKOH��Һ����ͨ��װ�â�ʵ�������϶�ͭ�����һ��ʱ���װ�â�����Һ��pH ����������С�����䡱����a���缫��Ӧ����ʽΪ ������ƽ�������װ�â������������仯��25.6g����Һ������ͭ��ʣ�ࣩ����װ�â������������ļ��� L����״���£���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ���ҵ�ĺ��ķ�Ӧ�ǣ�N2(g)��3H2(g)  2NH3(g)����H��Q kJ��mol��1�������仯����ͼ���ش��������⣺
2NH3(g)����H��Q kJ��mol��1�������仯����ͼ���ش��������⣺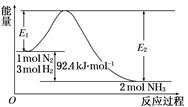
(1)�ڷ�Ӧ��ϵ�м����������Ӧ��������E1��E2�ı仯�ǣ�E1________��E2________(���������С�����䡱)��
(2)��500�桢2��107Pa�ʹ�����������һ�ܱ������г���0.5 mol N2��1.5 mol H2����ַ�Ӧ�ų�������________ 46.2 kJ(�<������>������)��
(3)���ڸ÷�Ӧ������˵���У���ȷ����________��
A����H>0����S>0 B����H>0����S<0
C����H<0����S>0 D����H<0����S<0
(4)��һ������N2(g)��H2(g)����1 L�ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬���N2Ϊ0.10 mol��H2Ϊ0.30 mol��NH3Ϊ0.10 mol������������´ﵽƽ��ʱH2ת��ΪNH3��ת����________���������¶ȣ�Kֵ�仯________(���������С�����䡱)��
(5)������(4)��Ӧ�������ܱ������У�����ߺϳɰ���H2��ת���ʣ����д�ʩ���е���________(����ĸ)��
A���������а�ԭ�����ٳ���ԭ����
B�����������ٳ����������
C���ı䷴Ӧ�Ĵ���
D�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���п���֤��H2(g)+I2(g) 2HI(g)�Ѵ�ƽ��״̬��������������
2HI(g)�Ѵ�ƽ��״̬��������������
�ٵ�λʱ��������n mol H2��ͬʱ,����n mol HI
��һ��H��H�����ѵ�ͬʱ������H��I������
�۰ٷֺ���w(HI)=w(I2)
�ܷ�Ӧ����v(H2)=v(I2)=v(HI)
��c(HI)��c(H2)��c(I2)=2��1��1
���¶Ⱥ����һ��ʱ,������Ũ�Ȳ��ٱ仯
���¶Ⱥ����һ��ʱ,������ѹǿ���ٱ仯
������һ��,��������ƽ����Է����������ٱ仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com