
【题目】含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
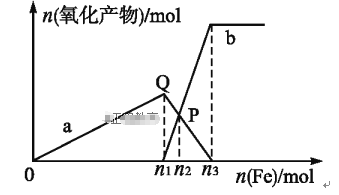
A. 曲线a表示Fe2+,曲线b表示Fe3+
B. P点时总反应的离子方程式可表示为5Fe+16H++NO3-![]() 3Fe2++2Fe3++4NO↑+8H2O
3Fe2++2Fe3++4NO↑+8H2O
C. n2=0.25
D. n3∶n1=3∶2
【答案】D
【解析】
试题A、向硝酸中加入铁粉时,发生两个过程,开始先生成硝酸铁,反应方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为4摩尔,利用方程式可计算出生成的硝酸铁为1摩尔,所以参加反应的铁为1摩尔,即n1=1,a为硝酸铁,故A错误;B、硝酸铁与过量的铁继续反应生成硝酸亚铁,方程式为:Fe+2Fe(NO3)3=3Fe(NO3)2,P点硝酸铁与硝酸亚铁物质的量相等的点,随后是硝酸铁与过量的铁继续反应生成硝酸亚铁,故B错误;C、根据铁原子守恒,铁的物质的量=硝酸亚铁物质的量+硝酸铁的物质的量,所以铁的物质的量为1.2摩尔,即n2="1.2mol" ,故C错误;D、向硝酸中加入铁粉时,发生两个过长,开始生成硝酸铁,根据硝酸的物质的量为1摩尔利用方程式可计算出生成的硝酸铁为0.25摩尔,所以参加反应的铁为0.25摩尔,将0.25摩尔的硝酸铁转化为硝酸亚铁需要的金属铁是0.125摩尔,所以n3=0.25+0.125=0.375摩尔,所以n3:n1=3:2,故D正确。


科目:高中化学 来源: 题型:
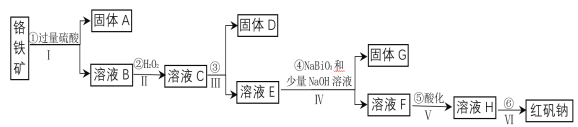
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是____________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和_______ 、______(填仪器名称)。
(3)③为加入物质来调节溶液的pH,则pH的合适范围是_______ 。
(4)写出④反应的离子方程式_____________________________。
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________。
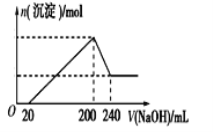
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )

X | Y | Z | |
A | NO2 | SO2 | BaCl2 |
B | NH3 | O2 | Al2(SO4)3 |
C | NH3 | CO2 | CaCl2 |
D | CO2 | SO2 | CaCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性
B. 油脂是高级脂肪酸的甘油酯,在常温下均呈固态
C. CH3CH(NH2)COOH既能与盐酸反应、又能与氢氧化钠溶液反应
D. 合成橡胶![]() 的单体之一是CH3-C≡C-CH3
的单体之一是CH3-C≡C-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2可以用Fe(NO3)3溶液吸收,某学习小组按如图装置展开探究:
取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
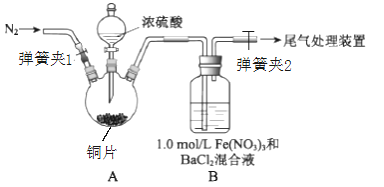
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为_______;检查图中连通装置A、B气密性的方法是___。
(2)加入浓硫酸之前先通入N2一段时间,其目的是___________;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是____________;若用NaOH溶液处理尾气,则发生反应的离子方程式为______________。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:______________
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0 mol·L-1 Fe(NO3)3溶液的pH ② ____________________ ③ ____________________ ④ ___________________ | ____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A. 甲的分子数比乙的分子数多 B. 甲的摩尔体积比乙的摩尔体积小
C. 甲的物质的量比乙的物质的量少 D. 甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com