
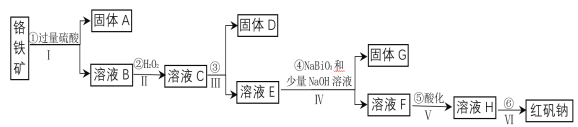
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是____________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和_______ 、______(填仪器名称)。
(3)③为加入物质来调节溶液的pH,则pH的合适范围是_______ 。
(4)写出④反应的离子方程式_____________________________。
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________。
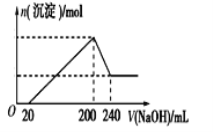
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
【答案】SiO2漏斗烧杯4.4-4.63NaBiO3 + 2Cr3++ 7OH-+ H2O = 2CrO42-+ 3Na+ +3Bi(OH)3↓2CrO42-+2H+ ![]() Cr2O72-+H2O2.5mol·L-1 0.10mol
Cr2O72-+H2O2.5mol·L-1 0.10mol
【解析】
由流程图可知,铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)加过量硫酸FeO、Cr2O3和Al2O3都溶解,SiO2不溶,经过滤分离得到固体A和溶液B,则固体A为SiO2;溶液B中含有Fe2+、Al3+、Cr3+,加入H2O2目的是将Fe2+氧化为Fe3+,第③步是调溶液pH,使Fe3+形成氢氧化铁沉淀,同时Al3+变成氢氧化铝沉淀而除去,固体D为氢氧化铁和氢氧化铝混合物;第④步加入NaBiO3和少量NaOH溶液将Cr3+转化为CrO42-;第⑤步中酸化是使CrO42-转化为Cr2O72-;第⑥步经蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠,据此分析。
(1)根据以上分析,固体A的成分是SiO2,
因此,本题正确答案为:SiO2;
(2)操作Ⅰ、Ⅲ、Ⅳ均是过滤,则用到的主要玻璃仪器有玻璃棒和漏斗、烧杯,
因此,本题正确答案为:漏斗 ;烧杯;
(3)从氢氧化物形成沉淀的pH表格可知,③为加入物质来调节溶液的pH,使Fe3+和Al3+沉淀,而Cr3+不沉淀,则pH的合适范围是4.4-4.6,
因此,本题正确答案为:4.4-4.6;
(4)常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-,则反应④的离子方程式为:3NaBiO3 + 2Cr3++ 7OH-+ H2O = 2CrO42-+ 3Na+ +3Bi(OH)3↓ ,
因此,本题正确答案为:3NaBiO3 + 2Cr3++ 7OH-+ H2O = 2CrO42-+ 3Na+ +3Bi(OH)3↓;
(5)⑤中酸化是使CrO42-转化为Cr2O72-,在转化过程中元素化合价不变,则该反应的离子方程式为2CrO42-+2H+ ![]() Cr2O72-+H2O,
Cr2O72-+H2O,
因此,本题正确答案为:2CrO42-+2H+ ![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,这说明酸过量,首先发生酸碱中和。当沉淀不再发生变化时需要氢氧化钠是200mL,继续加入氢氧化钠沉淀开始减小,即氢氧化铝开始溶解,溶解氢氧化铝消耗的氢氧化钠溶液是40mL,则生成氢氧化铝消耗的氢氧化钠溶液体积是120mL,所以与铁离子反应的氢氧化钠溶液体积是200mL-20mL -120mL=60mL,物质的量是5.0mol/L×0.06L=0.3mol,所以根据方程式Fe3++3OH-=Fe(OH)3↓,所以铁离子是0.1mol。
沉淀达到最大值时溶液中的溶质是硫酸钠,则根据原子守恒可知硫酸钠的物质的量是![]() =0.5mol,则硫酸的浓度是
=0.5mol,则硫酸的浓度是![]() =2.5mol/L。
=2.5mol/L。
因此,本题正确答案为:2.5mol·L-1 ;0.10mol。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水反应生成 HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比 1∶3 混合通入含水 8%的碳酸钠中制备 Cl2O,并 用水吸收 Cl2O(不含 Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为 → → →C→ 。_____
(2)写出 A 中反应的离子方程式______。
(3)装置 B 中多孔球泡和搅拌棒的作用是_________; 装置 C 的作用是_____。
(4)制备 Cl2O 的化学方程式为_____。
(5)反应过程中,装置 B 需放在冷水中,其目的是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_____、_____。
(测定浓度)
(7)用下列实验方案测定装置 E 所得溶液中次氯酸的物质的量浓度:
量取 10.00 mL 上述次氯酸溶液,并稀释至 100.00 mL,再从其中取出 10.00 mL 于 锥形瓶中,并加入 10.00 mL 0.8000 mol·L-1 的 FeSO4 溶液(过量),充分反应后,用0.05000 mol·L-1 的酸性 KMnO4 溶液滴定剩余的 Fe2+,消耗 KMnO4 溶液 24.00 mL,则 原次氯酸溶液的浓度为_____。判断下列情况对 HClO 含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若 FeSO4 标准溶液部分变质,会使测定结果_____;若配制酸性 KMnO4 溶液 时,定容时俯视刻度线,会使测定结果_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A.Ca2+、Na+、CO32-、NO3-B.Na+、Cl-、H+、OH-
C.Na+、Fe3+、Cl-、SO42-D.H+、K+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表标出的是元素周期表的一部分元素,回答下列问题:
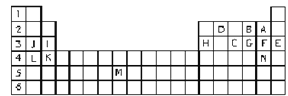
①表中用字母标出的14种元素中,化学性质最不活泼的是____________(用元素符号表示,下同),金属性最强的是____________,常温下单质为液态的非金属元素是____________。
②B、F、C气态氢化物中以________(填分子式)最不稳定。
Ⅱ. 有短周期的A、B、C、D、E 五种元素,它们在周期表的位置如图所示。已知A原子最外层电子数是次外层电子数的2倍。试回答下列问题:
![]()
(1) 元素E在周期表中位于第_______周期_______族。
(2) 元素A的最高价氧化物的电子式为________,元素D的原子结构示意图为________;
(3) 比较C、D两种元素最高价氧化物对应水化物的酸性强弱:______ > ______。(用分子式表示)
(4)元素C的气态氢化物与元素E的最高价氧化物对应水化物化合生成的正盐的化学式为___________,该盐的晶体类型为________。
(5) ①元素B所在周期的简单离子半径最小的是______。(用离子符号表示)
②元素C、D的简单氢化物沸点较高的是______。(用分子式表示)
(6)请用电子式表示Na2S的形成过程____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X.Y的叙述正确的是
A. X分子中所有原子一定在同一平面上
B. 1molY与足量氢氧化钠溶液共热最多可消耗8molNaOH
C. X、Y均能使Br2的四氧化碳溶液褪色
D. X→Y的反应为加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和甲酸甲酯互为同分异构体,其结构式分别如下
 和
和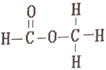
在下列哪种检测仪上显示出的信号是完全相同的
A. 李比希元素分析仪 B. 红外光谱仪
C. 核磁共振仪 D. 质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
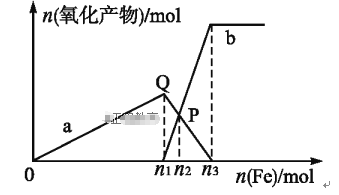
A. 曲线a表示Fe2+,曲线b表示Fe3+
B. P点时总反应的离子方程式可表示为5Fe+16H++NO3-![]() 3Fe2++2Fe3++4NO↑+8H2O
3Fe2++2Fe3++4NO↑+8H2O
C. n2=0.25
D. n3∶n1=3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com