
【题目】常温下,下列溶液可用铁质容器盛装的是
A.稀硝酸B.稀硫酸C.浓硝酸D.浓盐酸
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为:________________________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2++ 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++ NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_______________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2,n(NO)随时间的变化如下表所示。
2NO2,n(NO)随时间的变化如下表所示。
时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)从0~3s内,用NO表示的平均反应速率υ(NO)=_____________。
(2)图中表示NO浓度变化的曲线是_______(填字母代号)。
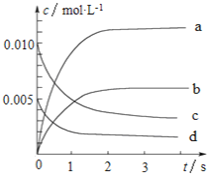
(3)达平衡时NO的转化率为________。
(4)能说明该反应已达到平衡状态的是_________(填序号)。
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.υ逆 (NO2)=2υ正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向________(填“正反应方向”、“逆反应方向”)移动。
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
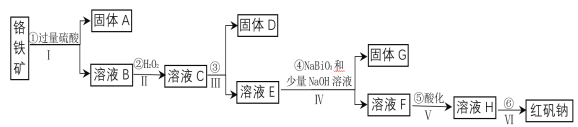
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是____________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和_______ 、______(填仪器名称)。
(3)③为加入物质来调节溶液的pH,则pH的合适范围是_______ 。
(4)写出④反应的离子方程式_____________________________。
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________。
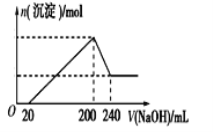
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )

X | Y | Z | |
A | NO2 | SO2 | BaCl2 |
B | NH3 | O2 | Al2(SO4)3 |
C | NH3 | CO2 | CaCl2 |
D | CO2 | SO2 | CaCl2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com