
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为:________________________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2++ 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++ NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_______________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
【答案】2Fe3++Cu═2Fe2++Cu2+0.1取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液Cu2++3SCN-=CuSCN↓+(SCN)23Fe2++4H++NO3-=3Fe3++NO↑+2H2O慢取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO![]() Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色
Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色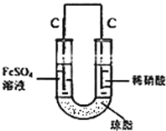
【解析】
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子;(2)图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验;由题目信息ii可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2;(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水;(4)①反应速率快的反应现象最先表现;②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,可以用K3[Fe(CN)6]溶液检验;③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡发生移动,最终Fe(NO)2+完全转化为Fe3+。
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子,反应离子方程式为:2Fe3++Cu═2Fe2++Cu2+;
(2)由反应2Fe3++Cu═2Fe2++Cu2+,可知图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验,故实验方案为:步骤1:取4mL 0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液,步骤2:取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液,由题目信息ii可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2,反应离子方程式为:2Cu2++4SCN-=2CuSCN↓+(SCN)2;
(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水,反应离子方程为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(4)①溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,反应Ⅰ的速率比反应Ⅱ的慢;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是:取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色;
(5)利用原电池原理,使NO与Fe2+在不同的电极区域生成,实验装置图为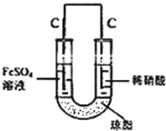 。
。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:①Cr2O72-+H2O![]() 2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)碱溶的目的是__________,所加40%NaOH不宜过量太多的原因是______________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_____________。
(3)使用下列用品来测定溶液的pH,合理的是_____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。

①图中仪器A的名称为_______。
②在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:___________。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体_____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI ![]() H2+I2 (气) 。下列叙述中一定属于平衡状态的是:
H2+I2 (气) 。下列叙述中一定属于平衡状态的是:
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不变化时
C. 混合气体的总压不变时
D. v(HI):v(H2):v(I2)=2:1:1时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
B. 当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为:OH-+H+![]() H2O
H2O
C. 乙溶液中含有的溶质是Na2CO3、NaHCO3
D. 乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾 病的药物。以2氯苯甲醛为原料合成该药物的路线如下:

(1)A中官能团名称为_____,A发生银镜反应的化学方程式为_____。
(2)C生成D的反应类型为_____。
(3)X(C6H7BrS)的结构简式为_____。
(4)写出C聚合成高分子化合物的化学反应方程式:_____。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有______种。
①除苯环之外无其他环状结构;②能发生银镜反应。 其中核磁共振氢谱中有5个吸收峰,且峰值比为2∶2∶1∶1∶1的结构简式为_____。
(6)已知: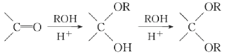 ,写出以乙烯、甲醇为有机原料制备化 合物
,写出以乙烯、甲醇为有机原料制备化 合物![]() 的合成路线(无机试剂任选)__________
的合成路线(无机试剂任选)__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水反应生成 HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比 1∶3 混合通入含水 8%的碳酸钠中制备 Cl2O,并 用水吸收 Cl2O(不含 Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为 → → →C→ 。_____
(2)写出 A 中反应的离子方程式______。
(3)装置 B 中多孔球泡和搅拌棒的作用是_________; 装置 C 的作用是_____。
(4)制备 Cl2O 的化学方程式为_____。
(5)反应过程中,装置 B 需放在冷水中,其目的是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_____、_____。
(测定浓度)
(7)用下列实验方案测定装置 E 所得溶液中次氯酸的物质的量浓度:
量取 10.00 mL 上述次氯酸溶液,并稀释至 100.00 mL,再从其中取出 10.00 mL 于 锥形瓶中,并加入 10.00 mL 0.8000 mol·L-1 的 FeSO4 溶液(过量),充分反应后,用0.05000 mol·L-1 的酸性 KMnO4 溶液滴定剩余的 Fe2+,消耗 KMnO4 溶液 24.00 mL,则 原次氯酸溶液的浓度为_____。判断下列情况对 HClO 含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若 FeSO4 标准溶液部分变质,会使测定结果_____;若配制酸性 KMnO4 溶液 时,定容时俯视刻度线,会使测定结果_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期主族元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,中子数为零。D元素原子的最外层电子数为m=6,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为(m/2-n)。F与D同主族。请回答下列问题:
(1)B元素在周期表中的位置是_____,G的离子结构示意图为______
(2)F与G最高价氧化物的水化物的酸性强弱为______>_____(填化学式)
(3)简单D离子和E离子的半径由大到小______>______(填离子符号)
(4)B和D简单气态氢化物的稳定性强弱为_____<_______(填化学式)
(5)F的一种氧化物中氧的质量分数为50%,写出该氧化物与G单质水溶液反应的化学方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com