
【题目】以有机物X为原料合成聚酯类高分子化合物H的路线如下: 
已知:
回答下列问题:
(1)X中宫能团的名称为______,Y→Z的反应类型为_______。
(2)H的结构简式是______ 。
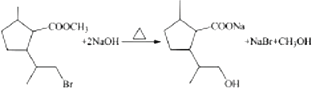
(3)W与NaOH水溶液反应的化学方程式为_______ 。
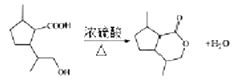
(4)M在一定条件下还可以合成含有六元环状结构的G,其反应方程式为______ 。
(5)满足下列条件的Z的同分异构体有______种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀
(6)参照题中合成路线图,设计以![]() 为原料(其它无机试剂任选)制备化合物
为原料(其它无机试剂任选)制备化合物 的合成路线如下:
的合成路线如下:
 请把路线图中“……”补充完整____________________________。
请把路线图中“……”补充完整____________________________。
【答案】 碳碳双键、醛基 酯化反应或取代反应 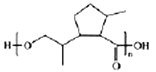
 12
12 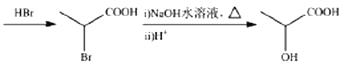
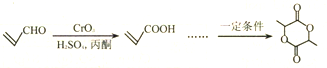
【解析】有机物X被氧化为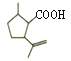 (Y),
(Y), 与甲醇发生酯化反应生成
与甲醇发生酯化反应生成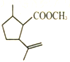 (Z),
(Z), 与溴化氢发生加成生成
与溴化氢发生加成生成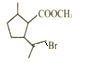 (W),
(W), 发生水解生成醇
发生水解生成醇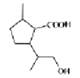 (M),然后该有机物发生缩聚反应生成高分子
(M),然后该有机物发生缩聚反应生成高分子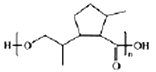 。
。
(1)根据有机物X的结构简式可知,X中官能团为碳碳双键、醛基;从有机物Z的结构及有机物Y与甲醇在浓硫酸加热条件下反应生成酯,可知Y→Z的反应类型为酯化反应或取代反应;正确答案:碳碳双键、醛基;酯化反应或取代反应。
(2)综上分析可知,H的结构简式是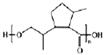 ;正确答案:
;正确答案: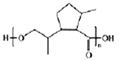 。
。
(3)W为 ,与NaOH水溶液反应时,酯基发生水解,溴原子发生水解,化学方程式为:
,与NaOH水溶液反应时,酯基发生水解,溴原子发生水解,化学方程式为: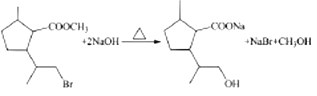 ;正确答案:
;正确答案: 。
。
(4)有机物M为 ,在浓硫酸作用下,加热,生成六元环状结构的酯,反应方程式为:
,在浓硫酸作用下,加热,生成六元环状结构的酯,反应方程式为: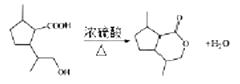 ;正确答案:
;正确答案: 。
。
(5)有机物Z为 ,满足条件的同分异构体:①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基,②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀,说明含有2个醛基;具体结构如下:针对
,满足条件的同分异构体:①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基,②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀,说明含有2个醛基;具体结构如下:针对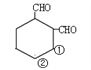 结构,①和②分别连-CH3和 -C2H5,结构有2种;针对
结构,①和②分别连-CH3和 -C2H5,结构有2种;针对 结构,①和②分别连-CH3和 -C2H5,结构有2种;针对
结构,①和②分别连-CH3和 -C2H5,结构有2种;针对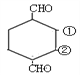 结构,①和②分别连-CH3和-C2H5,结构有1种;
结构,①和②分别连-CH3和-C2H5,结构有1种;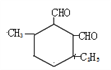 结构有1种;针对
结构有1种;针对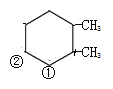 结构,①和②分别连-CH2-CHO 和–CHO,结构有2种;针对
结构,①和②分别连-CH2-CHO 和–CHO,结构有2种;针对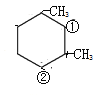 结构,①和②分别连-CH2-CHO 和–CHO,结构有2种;
结构,①和②分别连-CH2-CHO 和–CHO,结构有2种;
针对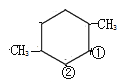 结构,①和②分别连-CH2-CHO 和–CHO,结构有1种;
结构,①和②分别连-CH2-CHO 和–CHO,结构有1种;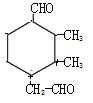 结构有1种;共计有12种;正确答案:12。
结构有1种;共计有12种;正确答案:12。
(6)![]() 氧化为
氧化为![]() ,
,![]() 与溴化氢发生加成生成
与溴化氢发生加成生成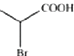 ,然后该有机物在氢氧化钠条件下发生水解,最后在酸化,得到
,然后该有机物在氢氧化钠条件下发生水解,最后在酸化,得到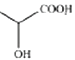 ,2分子的
,2分子的 发生酯化生成环酯;合成流程如下:
发生酯化生成环酯;合成流程如下: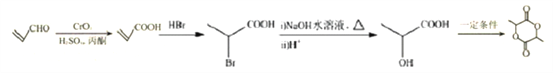 ;正确答案:
;正确答案: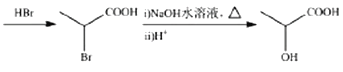 。
。


科目:高中化学 来源: 题型:
【题目】固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍.则下列判断正确的是( )
A.两种单质的摩尔质量比为1:4
B.生成物C中A的质量分数为75%
C.生成物C中A,B的原子个数比为3:1
D.反应前后气体分子数比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氧化还原滴定法测定某种草酸晶体(H2C2O4·X H2O)中结晶水分子数的实验步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液;
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知:H2C2O4的相对分子质量为90。
回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在_____ (填“酸式”或“碱式”)滴定管中。
(2)H2C2O4在溶液中与KMnO4溶液反应的化学方程式是______________
(3)到达滴定终点的标志是____________。
(4)根据上述数据计算X=________________。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值_________;
②若滴定管水洗后直接加入KMnO4标准溶液,则X值_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是

A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为硫酸,乙为贝壳(粉状),丙为苯酚钠溶液,验证硫酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.0 mol PCl3和2.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是
PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是
A. 0.8mol B. 0.4mol C. 小于0.4mol D. 大于0.4mol,小于0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有镁铝铜合金1.2 g,加入过量的盐酸中,在标准状况下放出氢气1.12 L,反应后过滤得沉淀0.2 g。若将此合金放入过量的烧碱溶液中,反应后,在标准状况下,产生氢气的体积约为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1,2-二氯乙烷常温下为无色液体,沸点为83.5 ℃,密度为1.23 g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如下实验装置。请回答下列问题:

(1)将导气管末端插入盛水的C试管中,用酒精灯加热(或用手捂)装置A中大试管,若__________现象,且移开酒精灯(或松开手)一会儿,导气管中出现________,则证明装置气密性良好。
(2)向装置A中先加入1,2二氯乙烷和NaOH的乙醇溶液,再加碎瓷片,碎瓷片的作用是__。
(3)为了使反应在75℃左右进行,常用的加热方法是________________,其优点是__________。
(4)与装置A中大试管相连接的长玻璃管的作用是____________,装置B的作用是______。
(5)为证明1,2-二氯乙烷已发生消去反应,则C中应装____________,现象是_______________,装置A中发生反应的化学方程式为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知95 ℃时水的离子积KW=1×10-12,25 ℃时KW=1×10-14,回答下列问题:
(1)95 ℃时水的电离常数K(95 ℃)________25 ℃时水的电离常数(填“>”、“=”或“<”)。
(2)95 ℃纯水中c(H+)________c(OH-)。(填“>”、“=”或“<”)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 ,其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com