
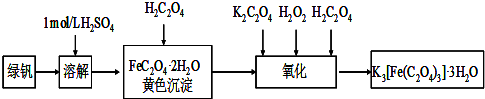
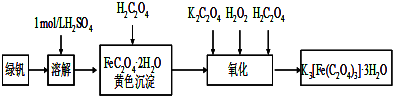
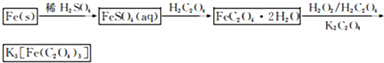
三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]·3H2O)有很重要的用途。可用如下流程来制备。根据题意完成下列各题:

(1)要从溶液中得到绿矾,必须进行的实验操作是 。(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4— 被还原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性。
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4—,被还原成Mn2+。
(2)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;
主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀。
(3)步骤2中,加入锌粉的目的是 。
(4)步骤3中,发生反应的离子方程式为: 。
(5)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量 。(选填“偏低”、“偏高”、“不变”)
(6)某同学将8.74 g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647 g/L(已折合成标准状况下)气体(是物质的量之比为4:5的混合气体)。研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3。写出该分解反应的化学方程式 。
(1)bcae (2)250ml容量瓶 洗涤 (3)还原Fe3+为Fe2+
(4)MnO4—+5Fe2++8H+=Mn2++ 5Fe3++4H2O
(5)偏高 (6)2K3[Fe(C2O4)3 3K2CO3+Fe+FeO+4CO+5CO2↑
3K2CO3+Fe+FeO+4CO+5CO2↑
【解析】
试题分析:(1)FeSO4在水中的溶解度比较大,而且受温度的影响变化较大,所以要从溶液中得到绿矾,必须进行的实验操作是蒸发浓缩、冷却结晶、过滤洗涤、干燥 。选项为b. c. a .e. (2) 配制成250ml无水三草酸合铁酸钾溶液要用250ml容量瓶,主要操作步骤依次是:称量、溶解、转移、洗涤、定容、摇匀。(3)Fe2+不稳定,容易被空气中的氧气氧化为Fe3+。为防止Fe3+的生成,在步骤2中,加入锌粉。(4) KMnO4与Fe2+发生氧化还原反应的离子方程式是:MnO4—+5Fe2++8H+=Mn2++
5Fe3++4H2O。(5)步骤2中,若加入的KMnO4的溶液的量不够,三草酸合铁酸钾晶体中的草酸根离子偏少,则Fe2+的含量就偏高。即测得的铁含量偏高。(6) 根据无水三草酸合铁酸钾(K3[Fe(C2O4)3])的质量8.74 g可计算其物质的量n(K3[Fe(C2O4)3])=
8.74 g÷437g/mol=0.02mol,n(K2CO3)= (0.02mol×3)
÷2=0.03mol.m(K2CO3)= 0.03mol×138g/mol=4.14g.n(Fe)= n(K3[Fe(C2O4)3])=0.02mol。由于在所得固体中无Fe3+。所以Fe只能以Fe单质及FeO的形式存在,假设Fe 、FeO的物质的量分别为M、N。则n(Fe)+n(FeO)=0.02;56M+72N=5.424.14.解得M= 0.01,N=0.01。m(气体)= 8.74 g-5.42g=3.32g,混合气体的平均摩尔质量为:1.647 g/L×22.4L/mol=36.89g/mol.n(气体)= 3.32g
÷36.89g/mol=0.09mol.根据物质的组成元素可知:气体只可能是CO、CO2的混合物。假设CO、CO2的物质的量分别为X、Y。则(28X+44Y)÷(X+Y)=36.89,解得X:Y=4:5。所以n(CO)=0.04mol;n(CO2)=0.05mol.故 n(K3[Fe(C2O4)3]) : n(K2CO3): n(Fe): n(FeO): n(CO): n(CO2)=0.02:0.03:0.01:0.01:0.04:0.05=2:3:1:1:4: 5.所以Fe(C2O4)3]分解的化学方程式为:K3[Fe(C2O4)3] 3K2CO3+Fe+FeO+4CO+5CO2↑
3K2CO3+Fe+FeO+4CO+5CO2↑
考点:考查从溶液中获得晶体的方法、步骤准确配制一定体积一定浓度的溶液的步骤及滴定法测物质组成等知识。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com