
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)⑥和⑦形成的分子中各个原子均满足8电子稳定结构,其立体构型为________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子和⑦形成的分子,中心原子上的价层电子对数为_______。
(4)元素⑦和⑧形成的化合物的电子式为__________。
(5)元素⑩的基态+2价离子的电子排布式是__________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:___________。
【答案】 Ti 三角锥形 4 ![]() 1s22s22p63s23p63d9或[Ar]3d9 Be(OH)2+2NaOH===Na2BeO2+2H2O
1s22s22p63s23p63d9或[Ar]3d9 Be(OH)2+2NaOH===Na2BeO2+2H2O
【解析】本题分析:本题主要考查原子结构与元素的性质。
(1)元素周期表中第3、4、5、6、7、8纵列元素(除镧系元素和锕系元素)属于d区元素,表中属于d区元素的是⑨对应的Ti。
(2)⑥是P,⑦是Cl,它们形成的分子中各个原子均满足8电子稳定结构,该分子是PCl3,中心原子P的价层电子对数是4,杂化轨道类型是sp3,其立体构型为三角锥形。
(3)某元素原子的外围电子排布式为nsnnpn+1,即为2s22p3,该元素为氮,该元素原子和⑦形成的分子是NCl3,中心原子上的价层电子对数为4。
(4)元素⑦和⑧形成的化合物是CaCl2,其电子式为![]() 。
。
(5)元素⑩是铜,铜的基态+2价离子的电子排布式是1s22s22p63s23p63d9或[Ar]3d9。
(6)②是Be,⑤是Al,②的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH===Na2BeO2+2H2O。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】(13分)【[化学—有机化学基础】没食子酸丙酯简称PG,结构简式为 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
(1)PG的分子式为 ,请写出PG分子中所含官能团的名称 ,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是 。
PG可发生如下转化:
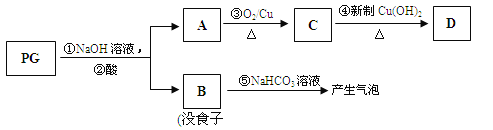
(2)A的结构简式为 ,1mol没食子酸最多可与 mol H2 加成。
(3)上图的有关变化中,属于氧化反应的有(填序号) 。
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号) 。
a.含有苯环 b.含有羧基 c.含有酚羟基 d.微溶于食用油
(5)反应④的化学方程式为: 。
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式: 。
i.含有苯环,且苯环上的一溴代物只有一种;
ii.既能发生银镜反应,又能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子检验的方法正确的是
A.NH4+:加NaOH溶液,加热,滴入酚酞溶液检验所得溶液
B.CO32-:加入稀盐酸,产生无色能使澄清石灰水变浑浊的气体
C.Fe3+:加入KSCN溶液,溶液呈血红色
D.Cl-:加入AgNO3溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、Na、Fe、Cu是常见的七种元素。
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是____________。
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是______(填写序号)。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________,1个分子中含有_________个π键。
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_____________。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长![]() _______cm。(用含ρ、NA的代数式表示)
_______cm。(用含ρ、NA的代数式表示)
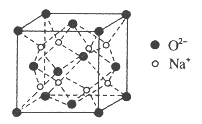
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号中为杂质),所用试剂和方法不正确的是
A. KCl溶液(I2):酒精,萃取
B. Fe(OH)3胶体(NaCl):渗析
C. Cl2(HCl):通过饱和食盐水洗气
D. NaHCO3溶液(Na2CO3):通入过量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 丁达尔效应可以用来鉴别胶体和溶液
B. 在水溶液中 NaHSO4 的电离:NaHSO4=Na++ HSO4-
C. 配置 FeSO4溶液时,需加入少量铁粉防止 Fe2+被氧化
D. 碳酸氢钠在医疗上可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)G位于周期表的____区(填“s”、“ p”、“d ”或“ds”)。
(2)画出W基态原子的核外电子排布图_______。
(3)A2Y的VSEPR模型名称为______。
(4)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理.写出X2Y的电子式____,其中心原子的杂化软道类型是______,1个X2Y分子中含的π键数为______。
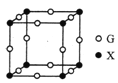
(5)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
(6)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为______cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com