
����Ŀ������һ�ֹ���Ԫ�أ�����������õĽ�������ش����и��⣺
��1�������к���һ����̼������(Fe3C)���������Ŀ����и������գ������д��ԵĹ������ʹ����ʯ��ˮ����ǵ����壬�÷�Ӧ�Ļ�ѧ����ʽΪ ��������Ӧ���ɵĴ��Թ��������ڹ������ᣬ�÷�Ӧ�����ӷ���ʽΪ ��
��2����Fe2+��Fe3+�Ĵ������£���ʵ��2SO2+O2+2H2O=2H2SO4��ת������֪��SO2�ķ���ͨ�뺬Fe2+����Һʱ������һ����Ӧ�����ӷ���ʽΪ2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+������һ��Ӧ�����ӷ���ʽΪ ��
��3�����᳧�����ջ�����(FeS2)����ȡ���ᣬʵ�����������᳧����(��Ҫ�ɷ���Fe2O3������FeS��SiO2)���̷��������������̷��Ĺ������£�

����������ϡH2SO4�����У����ǹ���ֱ��ܽ⣬�����е��������ɣ�д���÷�Ӧ�����ӷ���ʽ(ֻд����S�����ӷ���ʽ��������Ӧ����д��) ��
������ҺX�м���������м��Ŀ���� ��
��ȡ1.6g���þ�����Ʒ�����Һ������ mL 0.1000 mol/L �����Ը������Һ�պ���ȫ��Ӧ��������ɵ���Ʒ�к�47.5%������������
��4����֪Fe(OH)3���ܶȻ�����Ksp��1.1��10-36������ʱ��FeCl3��Һ�еμ�NaOH��Һ������ҺpH=3ʱ��ͨ������˵��Fe3+�Ƿ�������ȫ ��
(��ʾ����ij����Ũ��С��1.0��10-5 molL-1ʱ������Ϊ�����ӳ�����ȫ��)
���𰸡���1��Fe3C + 3O2![]() Fe3O4 + CO2��Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O��
Fe3O4 + CO2��Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O��
��2��4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O��3����2Fe3+ + H2S = 2Fe2+ + S�� + 2H+
��ʹFe3+��ȫת��ΪFe2+�����Ʊ��������̷�������10.70
��4�������c(Fe3��)��1.1��10-3molL-1��1��10-5 molL-1����Fe3+û��������ȫ
��������
�����������1��Fe3C�������Ŀ����и����������������������Ͷ�����̼����ӦΪFe3C+3O2![]() Fe3O4+CO2�����Թ��������ڹ���ϡ���ᷢ��������ԭ��Ӧ������������NO��ˮ�����ӷ�ӦΪ3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O���ʴ�Ϊ��Fe3C+3O2
Fe3O4+CO2�����Թ��������ڹ���ϡ���ᷢ��������ԭ��Ӧ������������NO��ˮ�����ӷ�ӦΪ3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O���ʴ�Ϊ��Fe3C+3O2![]() Fe3O4+CO2��3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O��
Fe3O4+CO2��3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O��
��2�����ܷ�Ӧ(2SO2+O2+2H2O=2H2SO4)��ȥ4Fe2++O2+4H+=4Fe3++2H2O�ɵõ����ӷ�ӦΪ2Fe3++SO2+2H2O=2Fe2++SO42-+4H+���ʴ�Ϊ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
��3����Fe2O3���Ժ�ϡ����֮�䷴Ӧ������������FeS���Ժ�ϡ����֮�䷴Ӧ�������⣬�����Ӿ��������ԣ�������л�ԭ�ԣ�����֮��ᷢ����ѧ��Ӧ��2Fe3++H2S=2Fe2++S��+2H+����������ʣ��ʴ�Ϊ��2Fe3++H2S=2Fe2++S��+2H+��
������Һ�������м���������м�����������Ժ�������֮�䷴Ӧ�����������ӣ����Ʊ��������̷����壬�ʴ�Ϊ��ʹFe3+��ȫת��ΪFe2+�����Ʊ��������̷����壻
�������Ը��������Һ�����Ϊx�����������������������Ϊ�������ķ���ʽΪ5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O�����ݷ���ʽ�У� =
=![]() �����x=0.0107L=10.70mL���ʴ�Ϊ��10.70��
�����x=0.0107L=10.70mL���ʴ�Ϊ��10.70��
��4����ҺpHΪ3ʱ����Һ��c(H+)=10-3����c(OH-)=10-11 ��Ksp=1.1��10-36=[c(OH-)]3��c(Fe3+)��c(Fe3+)=1.1��10-36/10-33=1.1��10-3(mol/L)��10-5 molL-1���ʴ�Ϊ��c(Fe3+)=1.1��10-3(mol/L)��10-5 molL-1��Fe3+û�г�����ȫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Ԫ�����ʵĵݱ���ɣ���ƿ�����ϵ��ʵ�顣
������1�����ơ��ء�þ������1 mol�ֱ�Ͷ�뵽������0.1 mol��L��1�������У�д�������ᷴӦ�����Ľ���������Ӧ�����ӷ���ʽ___________________________________��
��2����NaOH��Һ��NH4Cl��Һ�������NH3��H2O���Ӷ���֤NaOH�ļ��Դ���NH3��H2O���̶�������֤Na�Ľ����Դ���N������Ϊ������Ƿ��������˵�����ɣ�________________________________��
����������ͼװ�ÿ�����֤�ǽ����Եı仯���ɡ�
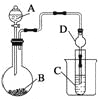 �����ȼ��г�����ʡ�ԣ�
�����ȼ��г�����ʡ�ԣ�
��3��ʵ�������ṩҩƷŨ���ᡢŨ���ᡢNa2S��Na2SiO3��MnO2��CaCO3����Ҫ֤���ǽ�����Cl>S��װ��A��B��C����װҩƷ�ֱ�Ϊ_________________________________��װ��C�е�ʵ������Ϊ�е���ɫ�������ɣ����ӷ���ʽΪ_____________________________________��
��4����Ҫ֤���ǽ����ԣ�S>C>Si����A�м�_________��B�м�Na2CO3��C�м�_________ ����۲�װ��C�е�ʵ������Ϊ�а�ɫ�������ɡ����ӷ���ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӳ�ȴ��۵�ߡ�������������������������һ����Ҫ�Ľṹ�մɲ��ϡ�һ���ù�ҵ�裨�������ء��ơ�����ͭ�����������֪����۵���1420����������������ˮ���������Ը�ʴ�����衣һ�ֺϳɵ�����Ĺ����������£�
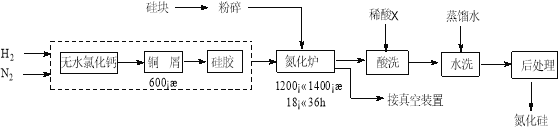
��1������N2��H2ʱ��ͭм�������ǣ� ���轺�������� ��
��2���ڵ���¯��3SiO2(s)+2N2(g)=Si3N4(s) ��H=��727.5kJ/mol����ʼʱΪʲôҪ�ϸ���Ƶ����������Կ����¶��� ����ϵ��Ҫͨ��������������Ϊ�� ��
��3��X������ ��ѡ������ᡱ�������ᡱ�������ᡱ��������ᡱ����
��4�����˵���������Ʒ����ˮϴ�ɾ��� ��
��5���ù������Դ���������ƣ�NaN3������Դ��ֱ��ȼ�����ɵ����裨�����û���Ӧ�����÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ����ѧ�����ѡ��1����ѡ���⣬
��һ����������Ѽ������������������Ѽ�ײ͵IJ���ԭ�����£��� Ѽ�⡢�� ��ۡ��� �ƹϡ��� ʳ�Ρ���ش�
��1���������۵��� ������ţ���ͬ������2�����������ʵ��� ��
��3������ά���ص��� �� ��4�����ڵ�ζ������ ��
��������������������������ͷ�չ����Ҫ���ʻ�����
��1���Թܡ��ձ�����ƿ�Ȼ�ѧ��������Ҫ������ ��
A������ B���մ�
��2��������Ŀǰ�����������Ͻ𡣸����Ӵ���ˮ�����绯ѧ��ʴ���为����ӦʽΪ ��
A��O2+2H2O + 4e- = 4OH- B��Fe - 2e -= Fe2+
������������ˮ��Ҫ��Դ���ȼҵ�����Ϲ�ҵ��δ�����������ŷš�ij�������Է�ˮ����Ҫ��Hg2+��H+��Na+��Cl���ȣ��Ĵ���������������ͼ��ʾ��
 ��ش�
��ش�
��1��������ˮδ������ֱ���ŷŵ�Σ���� ������ĸ����
a. ���ˮ����Ⱦ b. ���������ж�
��2�����ڷ�ˮpHʱ�������ҺA������ ������ĸ����
a. ���� b. NaOH��Һ
��3��Na2S��Hg2+������Ӧ�����ӷ���ʽ�� ��
��4���÷�ˮ����������й��������£��������Ӻ��Բ��ƣ���
���� | Na+ | Fe2+ | Cl�� | SO42�� |
Ũ�ȣ�mol/L�� | 3.0��10-4 | 2.0��10-4 | 2.5��10-4 |
��c(Fe2+) = mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5:�л���ѧ������H����Ϊ�ܼ��������������ᡢճ�ϼ��ͳ�����ȡ���ͼ�Ǻϳ�H�߾���M��һ�ֺϳ�·�ߣ�
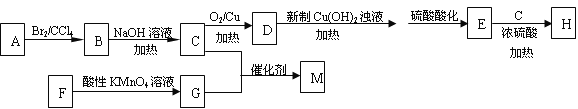
��֪������Ϣ��
��A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ��
��H���ӽṹ�к�����Ԫ����
����F�����������Ϊ106������ʹ���Ը��������Һ��ɫ��������ʹ���CCl4��Һ��ɫ��
���˴Ź���������ʾF���ӽṹ��ֻ�����ֻ�ѧ�������⡣
�� ��
��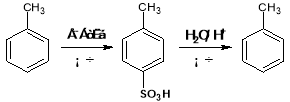
�ش�����������
��1����C����D�Ļ�ѧ����ʽΪ ����Ӧ����Ϊ
��2��H����ѧ������ ����C��G����M�Ļ�ѧ����ʽ��
��3��F���ṹ��ʽΪ
��4��ͬʱ������������G��ͬ���칹���� ��(�����������칹)��
������Na2CO3��Һ��Ӧ������ɫ��ζ����
����FeCl3��Һ������ɫ��Ӧ
���к˴Ź�����������4��壬�������Ϊ1:2:2:1�Ľṹ��ʽ��_______��
��5��������F��ͬ���칹��X�����²���ɺϳ� ��
��
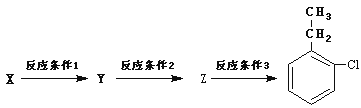
��Ӧ����1��ѡ����Լ�Ϊ ����Ӧ����2��ѡ����Լ�Ϊ ��Z�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2010�괺��2013���������귢��������ʡ�����غ���ǣ����ȫ��������ģ��������Ƕ�ˮ��Դ���ٴ����ӡ�ˮ��������������Ҫ��ѧ���ʣ��й�ˮ�ķ�Ӧ�кܶࡣ
��1���õ���ʽ��ʾH2O���γɹ��� ��
��2����pH=1��ˮ��Һ�У���NH4+��Al3+��Br-��SO42- �� Na+��Fe2+��Cl-��NO3-
��K+��Ba2+��Cl-��NO3- ��K+��Na+��HCO3-��SO42-���������У�һ������������� (�����)��
��3�������з�Ӧ�У�ˮ�������������� (����ĸ����ͬ)��ˮ�Ȳ����������ֲ�����ԭ������ ��
A��2F2��2H2O��4HF��O2 B��2Na2O2��2H2O��4NaOH��O2��
C��CaH2��2H2O��Ca(OH)2��2H2�� D��3Fe��4H2O![]() Fe3O4��4H2]
Fe3O4��4H2]
��4���������ߺš��ɴ��ϵ�������Ҫ������̫���ܺ�ȼ�ϵ�أ�H2��O2��KOH��ˮ��Һ���γ�����ȼ�ϵ�أ������ĵ缫��ӦΪ ����Ӧ������ˮ�����������Ϊ����Ա������ˮ�����õ�1.8 L����ˮʱ�������ת�Ƶĵ�����ԼΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͭ��ˮ�Ĺ���������м���Ӧ��DZ�ܣ��Ǽ��߿���ǰ������ɫ�����������Ŀǰ��Ҫ�ĺϳɷ����е�ⷨ�����¹��෨�ȡ�
��1�����о����������������ɹ��Ƶ���Cu2O ����������װ����ͼ��
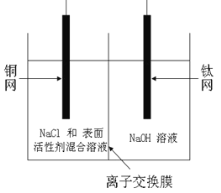
�õ�ص�������Ӧ����ʽΪ ���ӽ���ĤΪ_______(��������)���ӽ���Ĥ��ͭ��Ӧ���ӵ�Դ��_____����
��2���ڸ������ü��齫��״CuO ��ԭҲ���Ƶ�Cu2O��
��֪����2Cu(s)��1/2O2(g)=Cu2O(s)����H = -169kJ/mol
��CH4(g)��2O2(g)=CO2(g)+2H2O(g)����H = -846.3 kJ/mol
�� Cu(s)��1/2O2(g)=CuO(s)����H = -157 kJ/mol
��÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�__________��
��3������ͬ���ܱ������У��õ���������������Cu2O(�ò�ͬ�����Ƶ�)�ֱ���д��ֽ�ˮ��ʵ�飺2H2O(g) ![]() 2H2(g)+O2(g) ��H>0��ˮ����Ũ����ʱ��t�仯���±���ʾ��
2H2(g)+O2(g) ��H>0��ˮ����Ũ����ʱ��t�仯���±���ʾ��
��� |
| 0 | 10 | 20 | 30 | 40 | 50 |
�� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
�� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
�ٶԱ�ʵ����¶ȣ�T2 T1(���������������)��ԭ����___________________��
��ʵ���ǰ20 min��ƽ����Ӧ���� v(O2)=
�۱Ƚϲ�ͬ�����Ƶõ�Cu2O�Ĵ�Ч��Ӧѡ��__________��ʵ�飬ԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
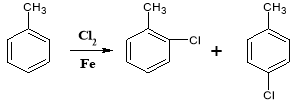
����Ŀ�����и��������У�����ͬλ�ص��ǣ�����ţ���ͬ�� ������ͬ����������� ����Ϊͬϵ����� ������ͬ���칹����� ������ͬ�����ʵ��� ��
A��O2��O3 B.D��T C.![]()
D.![]() E.
E.

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���Ԫ����������ѧϰ���о�������ʵ�����к���Ҫ�����á��±��г�������������Ԫ�������ڱ��е�λ�á�

��ش�(��������Ӧ��Ԫ�ط��Żش�����)
��1���ڱ�����д������Ԫ�ط��ţ�д��Ԫ�ط�����________����________����________��
��2�����л�ѧ��������õ���________(��Ԫ�ط���)��
��3������������������Ԫ�ص��������Ӧ��ˮ�����У�������ǿ����________(�ѧʽ)��
��4��Ԫ��������������ԭ�Ӱ뾶�ɴ�С��˳������Ϊ________(��Ԫ�ط���)
��5��Ԫ�������⻯��Ļ�ѧʽ��________�����⻯������ˮ��������Һ��pH________(������������������������)7��
��6��Ԫ������Ԫ�����γɵĻ�����ĵ���ʽ��________�����������ոû���������________ɫ��
��7��________(�ѧʽ)�ĵ��ʼȿ��Ժ������ֿ��Ժ�����������Һ��Ӧ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com