
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑩九种元素在周期表中的位置。

请回答:(以下用相应的元素符号回答问题)
(1)在表里填写①~⑩元素符号,写出元素符号①________、③________、⑧________。
(2)其中化学性质最不活泼的是________(填元素符号)。
(3)在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是________(填化学式)。
(4)元素①、②、⑤按原子半径由大到小的顺序依次为________(填元素符号)
(5)元素⑥的氢化物的化学式是________,该氢化物溶于水,所得溶液的pH________(填“<”、“>”或“=”)7。
(6)元素②与元素⑧形成的化合物的电子式是________,高温下灼烧该化合物火焰呈________色。
(7)________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,
【答案】(1)①H、③为Mg、⑧为Cl;(2) He (3) NaOH;(4) K>Na>H;(5) NH3;>;(6)![]() ;黄;(7) Al
;黄;(7) Al
【解析】试题分析:由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He;(1)在表里填写①~⑩元素符号,写出元素符号①H、③为Mg、⑧为Cl;
(2) 化学性质最不活泼的是He ;(3) 同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强,最高价氧化物的水化物的碱性越强,故NaOH的碱性最强,故答案为:NaOH;(4)同一主族元素的原子半径随原子序数的递增而增大,即:K>Na>H; (5) 元素⑥的氢化物是NH3,该氢化物溶于水得到一水合氨,一水合氨电离生成铵根离子与氢氧根离子,溶液呈碱性,溶液pH>7,故答案为:NH3;>;
(6) 元素②与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成,电子式为![]() ;含有Na元素,高温下灼烧该化合物火焰呈黄色; (7) Al的单质既可以和盐酸又可以和氢氧化钠溶液反应。
;含有Na元素,高温下灼烧该化合物火焰呈黄色; (7) Al的单质既可以和盐酸又可以和氢氧化钠溶液反应。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】铁是一种过渡元素,金属铁是最常用的金属。请回答下列各题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 。上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为 。
(2)在Fe2+或Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知含SO2的废气通入含Fe2+的溶液时,其中一个反应的离子方程式为2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+,则另一反应的离子方程式为 。
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾。利用烧渣制绿矾的过程如下:

①烧渣溶于稀H2SO4过程中,先是固体大部分被溶解,接着有单质硫生成,写出该反应的离子方程式(只写生成S的离子方程式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
③取1.6g所得晶体样品配成溶液,滴入 mL 0.1000 mol/L 的酸性高锰酸钾液刚好完全反应,经计算可得样品中含47.5%的硫酸亚铁。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全 。
(提示:当某离子浓度小于1.0×10-5 molL-1时可以认为该离子沉淀完全了)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林口服时,具有解热镇痛作用。是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成。它的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
【反应原理及部分装置】

【实验流程】

已知:①醋酸酐遇水分解生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,副产物为高分子化合物,难溶于水。
回答下列问题:
(1)合成过程中要控制温度在85℃~90℃,最合适的加热方法 。
(2)用图1装置过滤比普通漏斗过滤的优点是 。
(3)粗产品提纯:
①分批用少量饱和NaHCO3溶液溶解粗产品,目的是 ;判断该过程结束的现象是 。
②加浓盐酸、冷却后的操作是__________、______、干燥、称重、计算产率。
③纯度检验:取少许产品加入盛有2 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。可能的原因是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品mg;
Ⅱ.将样品研碎,溶于V1 mL a mol/LNaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
已知:乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:

则阿司匹林药片中乙酰水杨酸质量分数的表达式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,其作用用离子方程式表示为____________,调节pH至9后,升温至30℃,通空气将氨赶出并回收;
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
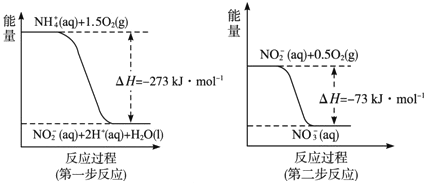
①第一步反应的热化学方程式是____________;
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____________;
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32gCH3OH转移6mol电子,则该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:

注:经检验黑色固体为Ag。
①白色沉淀的化学式是______________________。
②甲同学得出Ag+氧化了Fe2+的依据是_________________。

(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是______________________。
②b中电压表指针逆向偏移后,银为_______________极(填“正”或“负”)。
③由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:

①实验Ⅲ_________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_______________。
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2。具体生产流程如下:

回答下列问题:
(1)装置a用磷酸吸收NH3.若该过程在实验室中进行,请画出装置a的示意图.___________;
(2)热交换器是实现冷热交换的装置.化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是___________;
(3)依题意猜测固体A中一定含有的物质的化学式是___________(结晶水部分不写).
(4)利用生产磷铵排放的废渣磷石膏制取硫酸,其中SO2生产硫酸的工艺流程图如图所示:

①在A处二氧化硫被氧化成三氧化硫,设备A的名称是___________,设备A中发生反应的化学方程式是___________,为提高三氧化硫的产率,该处应采用___________(填“等温过程”或“绝热过程”)为宜。
②在D处进行二次催化处理的原因是___________;
③B处气体混合物主要是氮气和三氧化硫。此时气体经过C后不立即进入D是因为:___________;
④20%的发烟硫酸(SO3的质量分数为20%)1吨需加水___________吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.能用于测定硫酸尾气中SO2含量的是___________(选填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B的单质在D的单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A的单质在F的单质中燃烧伴有苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)F的元素符号为___________________________。
(2)A在周期表中的位置是 。
(3)A与D反应时,可以形成原电池,在原电池的负极上发生氧化反应的物质是________。
(4)B、D、E组成的一种盐中,E的质量分数为约43%,其俗名为 。
(5)E在D中燃烧产物的电子式为____________________________________。
(6)A与E可以形成离子化合物,该化合物与水反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核外电子排布时,可以用K、L、M来表示第一层、第二层、第三层;A元素原子M电子层上有3个电子,B元素与A元素的原子核外电子层数相同,B元素的原子最外层电子数为1;C元素的原子比B元素原子少4个电子。
(1)B元素的原子结构示意图为 ;
(2)A元素在周期表中的位置 ;
(3)含有B元素的化合物在无色火焰上灼烧时火焰呈 色。
(4)A和B的最高价氧化物的水化物相互反应的离子方程式为: 。
(5)C元素的氧化物有多种,其中颜色为红棕色的是——————(填化学式)
(6)A与B相比,A的金属性————B的金属性(填“强于”或“弱于”)
(7)A的单质————————与NaOH溶液反应(填“能”或“不能”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水资源是一个重要的研究课题,下面是工业上用海水制备食盐、纯碱、金属镁等物质的一种流程:

完成下列填空
(1)气体Y是 (填化学式),溶液II中发生反应的化学方程式是: 。实验室可用右图装置模拟此制备过程,仪器c的名称 ,反应时a管应通入 。

(2)为了测定碳酸氢钠中杂质氯元素的含量,先称取a g试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100 mL溶液,取出20 mL注入锥形瓶中,然后用c mol/LAgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。已知:常温下Ksp(AgCl)=2×10-10 ,Ksp(Ag2CrO4)=1.12×10-12 ,Ag2CrO4为砖红色。
①当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5 mol·L-1,则此时溶液中的c(CrO42-)= mol·L-1。
②滴定过程中,使用棕色滴定管的原因是 ;当观察到出现 时停止滴定,若此时消耗了AgNO3标准溶液v mL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为 。
③下列情况会造成实验测定结果偏低的是 。
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com