
����Ŀ��ԭ�Ӻ�������Ų�ʱ��������K��L��M����ʾ��һ�㡢�ڶ��㡢�����㣻AԪ��ԭ��M���Ӳ�����3�����ӣ�BԪ����AԪ�ص�ԭ�Ӻ�����Ӳ�����ͬ��BԪ�ص�ԭ������������Ϊ1��CԪ�ص�ԭ�ӱ�BԪ��ԭ����4�����ӡ�
��1��BԪ�ص�ԭ�ӽṹʾ��ͼΪ ��
��2��AԪ�������ڱ��е�λ�� ��
��3������BԪ�صĻ���������ɫ����������ʱ����� ɫ��
��4��A��B������������ˮ�������Ӧ�����ӷ���ʽΪ�� ��
��5��CԪ�ص��������ж��֣�������ɫΪ����ɫ�������������������ѧʽ��
��6��A��B��ȣ�A�Ľ�������������B�Ľ����ԣ�����ǿ����������������
��7��A�ĵ���������������������NaOH��Һ��Ӧ����������������������
���𰸡�(1)![]() (2) �������� ����A��(3)��ɫ(4) Al(OH)3+OH-= AlO2-+ 2H20
(2) �������� ����A��(3)��ɫ(4) Al(OH)3+OH-= AlO2-+ 2H20
(5) NO2(6) ��(7) ��
�����������������AԪ��ԭ��M���Ӳ�����3�����ӣ�����A��AlԪ�أ�BԪ����AԪ�ص�ԭ�Ӻ�����Ӳ�����ͬ��BԪ�ص�ԭ������������Ϊ1��B��NaԪ�أ�CԪ�ص�ԭ�ӱ�BԪ��ԭ����4������,C��NԪ�� ��
��1��NaԪ�ص�ԭ�ӽṹʾ��ͼΪ![]() ��
��
��2��AlԪ�������ڱ��е�λ�õ������� ����A�壻
��3��NaԪ�صĻ���ʻ�ɫ��
��4�����������������������Ӧ�����ӷ���ʽΪ��Al(OH)3+OH-= AlO2-+ 2H20��
��5��NԪ�ص���������ɫΪ����ɫ����NO2
��6��ͬ���ڴ����ҽ����Լ�����Al��Na��ȣ�Al�Ľ���������Na�Ľ�����
��7��Al ��NaOH��Һ��Ӧ�ܷ�Ӧ����ƫ�����ƺ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����ͬλ�ص��ǣ�����ţ���ͬ�� ������ͬ����������� ����Ϊͬϵ����� ������ͬ���칹����� ������ͬ�����ʵ��� ��
A��O2��O3 B.D��T C.![]()
D.![]() E.
E.

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���Ԫ����������ѧϰ���о�������ʵ�����к���Ҫ�����á��±��г�������������Ԫ�������ڱ��е�λ�á�

��ش�(��������Ӧ��Ԫ�ط��Żش�����)
��1���ڱ�����д������Ԫ�ط��ţ�д��Ԫ�ط�����________����________����________��
��2�����л�ѧ��������õ���________(��Ԫ�ط���)��
��3������������������Ԫ�ص��������Ӧ��ˮ�����У�������ǿ����________(�ѧʽ)��
��4��Ԫ��������������ԭ�Ӱ뾶�ɴ�С��˳������Ϊ________(��Ԫ�ط���)
��5��Ԫ�������⻯��Ļ�ѧʽ��________�����⻯������ˮ��������Һ��pH________(������������������������)7��
��6��Ԫ������Ԫ�����γɵĻ�����ĵ���ʽ��________�����������ոû���������________ɫ��
��7��________(�ѧʽ)�ĵ��ʼȿ��Ժ������ֿ��Ժ�����������Һ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����̬ͭԭ�ӵĺ���δ�ɶԵ�����ĿΪ___________��
��2�����ݵ�2����Ԫ�ص�һ�����ܵı仯���ɣ�������ͼB��FԪ�ص�λ�ã���С�ڵ���C��N��O����Ԫ�ص����λ�á�

��3��NF3����NH3��F2��Cu���������·�Ӧֱ�ӵõ���
2NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
������ѧ����ʽ�е�5�����������ľ���������___________��
��4��BF3��һ����ˮ�γɣ�H2O��2BF3����Q��Q��һ�������¿�ת��ΪR:
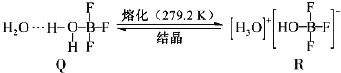
������Q�и��������ǿ�����������___________������ţ���
a�����Ӽ� b�����ۼ� c����λ�� d�������� e����� f�����»���
��R�������ӵĿռ乹��Ϊ___________�������ӵ�����ԭ�ӹ������1��2sԭ�ӹ����___________��___________ԭ�ӹ���ӻ���
��5����ͭ�ۼ���Ũ��ˮ��.��ͨ����������ַ�Ӧ����Һ�����ɫ��һ��ͭ���ӵ���λ�����.
�÷�Ӧ�����ӷ���ʽΪ___________��
��6��������Ϊ�������������ṹ�����ͣ�.�����е���λ��Ϊ___________����������ܶ�Ϊ��g/cm3����ԭ�Ӱ뾶Ϊ___________cm���ú�����NA�Ĵ���ʽ��ʾ�����ػ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A 0.2 mol ����������ȫȼ�պ�����CO2��H2O��1.2 mol���Իش�
��1����A�ķ���ʽΪ_____________��
��2����ȡһ��������A��ȫȼ�պ�����CO2��H2O��3 mol������________g��A�μ��˷�Ӧ��ȼ��ʱ���ı�״���µ�����___________L��
��3������A����ʹ��ˮ��ɫ������һ��������������������ȡ����Ӧ����һ��ȡ����ֻ��һ�֣�����A�Ľṹ��ʽΪ__________________��
��4������A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4��������A�����еĽṹ��ʽΪ__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼�IJ������������ҹ���Դ�����һ����Ҫս�Է�����
��1����ѧ�������CO2��ȡC��̫���ܹ�����ͼ1��ʾ����������ϵͳ�������ķ�Ӧ��![]() =6����FexOy�Ļ�ѧʽΪ____________��
=6����FexOy�Ļ�ѧʽΪ____________��
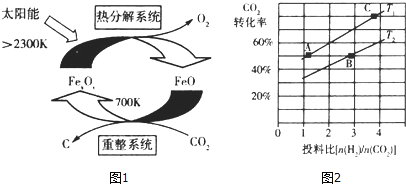
��2����ҵ����CO2��H2��Ӧ�ϳɶ���������֪��
CO2(g)+3H2(g)�TCH3OH(g)+H2O(g)��H1=-53.7kJmol-1
CH3OCH3(g)+H2O(g)�T2CH3OH(g)��H2=+23.4kJmol-1
��2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)��H3= ____________ kJmol-1
CH3OCH3(g)+3H2O(g)��H3= ____________ kJmol-1
��3����һ�������£������ϳɶ����ѵķ�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����____________(�����)��
a���淴Ӧ������������С b��H2��ת��������
c����Ӧ�������ٷֺ�����С d�������е�![]() ֵ��С
ֵ��С
����ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת������ͼ2��ʾ��
T1�¶��£���6molCO2��12molH2����2L���ܱ������У�5min��Ӧ�ﵽƽ��״̬����0��5min�ڵ�ƽ����Ӧ����v(CH3OCH3)= ____________ ��
�������ϳɶ����ѵĹ��������CO2��ת���ʿɲ�ȡ�Ĵ�ʩ��____________��____________ (�ش�2��)��
��4�������£��ð�ˮ����CO2�ɵõ�NH4HCO3��Һ����NH4HCO3��Һ�У�c(NH4+)____c(HCO3-)(����>������<��������=��)����ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=____________ (��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5mol/L�� H2CO3�ĵ���ƽ�ⳣ��K1=4��10-7 mol/L��K2= 4��10-11 mol/L)
NH3��H2O+H2CO3��ƽ�ⳣ��K=____________ (��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5mol/L�� H2CO3�ĵ���ƽ�ⳣ��K1=4��10-7 mol/L��K2= 4��10-11 mol/L)
��5���ݱ����Զ�����̼Ϊԭ�ϲ�������ĵ缫���ǿ���ԵĶ�����̼ˮ��Һ�ɵõ�����ȼ�ϣ���ԭ����ͼ3��ʾ�����ʱ����b����������ϩ�ĵ缫��ӦʽΪ____________��
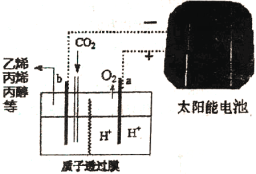
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ������Ԫ�ط��Ż�ѧʽ�ش��������⡣
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
��1��д��������Ԫ����ɵķ��ӵĵ���ʽ��_______��
��2��������̬�⻯���������������ˮ���ﷴӦ�ķ���ʽΪ , ���������г���Ԫ���������Ӱ뾶��С���� �������ӷ��ţ���
��3���ڢۢ�����Ԫ������������Ӧ��ˮ���������ǿ���� (�ѧʽ)��Ԫ�������⻯��ĽṹʽΪ �� ���⻯���Ԫ�������ʷ�Ӧ�Ļ�ѧ����ʽΪ ��
��4��Ԫ�����ĵ������ڢ��γɵĻ��������Һ��Ӧ�����ӷ���ʽΪ ���ڷ�Ӧ�����Һ�м����л��ܼ��������õ�ʵ������Ϊ ��
��5������ͬ���壬�������ڵ�Ԫ�ص��������ĵ�����ȼ�����ɵĻ�����ĵ���ʽ ���ܢ��Ԫ�ص����ӵĻ�ԭ����ǿ����˳��Ϊ �������ӷ��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu���仯�����ڿ�ѧ�о���ҵ�����о���������;����ش��������⣺
��1����CuSO4Ũ��Һ�еμ���ˮ������ɫ������Һ���������м��������Ҵ������������ӷ�Ӧ����ʽ__________________________��
��2������ͭ��Һ�е��백��������(H2N��CH2COONa)���ɵõ������A����ṹ��ͼ��
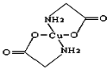
��SO42-��Sԭ�ӵĹ���ӻ�������________________��
��A��̼ԭ�ӵĹ���ӻ�����Ϊ________________��
��1mol���������ƺ��Цļ�����ĿΪ_________��
��3��Ԫ�ؽ�(Au)�������ڱ��еĵ������ڣ���Cuͬ�塣һ��ͭ�Ͻ�����������������ܶѻ��Ľṹ���ھ�����Cuԭ�Ӵ������ģ�Auԭ�Ӵ��ڶ���λ�ã��úϽ���ÿһ���Ϊ_________(����ò㡱���������ò㡱)���þ����У�ԭ��֮�����������_________��
��4������������д���ܣ���ԭ�ӿɽ��뵽��Cuԭ����Auԭ�ӹ��ɵ��������϶�У�����Cuԭ����Auԭ�ӵ�ͬ�������þ��崢���ľ����ṹ��CaF2�ľ����ṹ�ṹ���ƣ��þ��崢���Ļ�ѧʽӦΪ_________����Cuԭ����Auԭ�ӵľ���Ϊacm����þ��崢�����ܶ�Ϊ_________��(��a�ı���ʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ű�����ཡ������������Ӱ�졣ȼú������β�� ����ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2C02(g)+N2 (g) ��H ��0 ��
2C02(g)+N2 (g) ��H ��0 ��
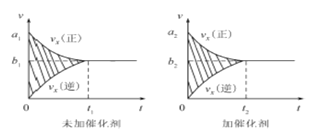
�ٸ÷�Ӧ������ʱ��ͼ������ͼ����ͼ��ʾ���������������䣬���ڷ�Ӧǰ������ʵĴ�������������ʱ��ͼ������ͼ����ͼ��ʾ������˵����ȷ���� (���Ӧ��ĸ����
A��a1��a2 B��b1 ��b2 C��t1��t2
D����ͼ����Ӱ����������� E.��ͼ����Ӱ�����������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ���
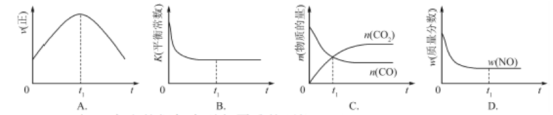
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⡣úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ����֪��CH4(g)+2N02(g) = N2(g)+C02(g)+2H20(g) ��H=-867 kJ/mol
2N02(g)= N204(g) ��H= - 56.9 kJ/mol H20(g) = H20(l) ��H = - 44.0 kJ/mol
д��CH4����ԭN204 (g)����N2��H20��1�����Ȼ�ѧ����ʽ�� ��
��3��CH4��H20(g)�ڴ������淢����ӦCH4 + H20 = C0 + 3H2 ���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�����±���
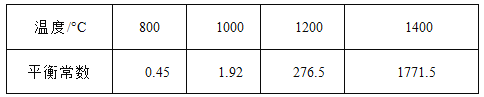
�ٸ÷�Ӧ�� ��Ӧ(����ȡ����� ������
��T��ʱ����1L�ܱ�������Ͷ��1mol CH4 ��1mol H20(g)��ƽ��ʱC(CH4)=0��5 mol��L-1 , ���¶��·�ӦCH4 + H20 = CO+3H2��ƽ�ⳣ��K= ��
��4������ȼ�ϵ�ؿ����������������ʡ���ͼ�����ü���ȼ�ϵ�ص��100mL lmol/Lʳ��ˮ�����һ��ʱ����ռ�����״���µ�����2.24 L(�������Һ������䣩��
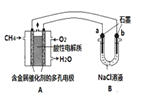
�ټ���ȼ�ϵ�صĸ�����Ӧʽ�� ��
�ڵ�����Һ��pH = �� (��������������������Һ��Ӧ����
�������������������ڱ�״������ L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com