
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过__________方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
![]()
该配离子中含有的化学键类型有_______________(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含_____________mol σ键。
(6)某种磁性氮化铁的结构如图所示

N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为______g/cm3(列出计算式)。
【答案】X—射线衍射 1s22s22p63s23p63d104s1 Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定 16 ABD 10 ![]()
【解析】
(1)用X光照射晶体发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)Cu为29号元素,位于第三周期第ⅠB族;
(3)在Cu2O中Cu+原子处于d轨道的全满的稳定状态,而若再失去1个电子变为不稳定状态;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍;
(4)Cu2+与乙二胺中N原子形成配位键;在配位体H2N-CH2-CH2-NH2中C原子与C原子之间形成非极性键;不同元素的原子之间形成极性键;
(5)Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键;
(6)根据均摊法计算晶胞中原子数目,可计算晶胞质量m,由晶胞参数计算晶胞体积V,根据晶体密度ρ=![]() 计算即可。
计算即可。
(1)从外观无法区分三者,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无X-射线衍射现象即可确定,故答案为:X-射线衍射;
(2)29号元素Cu元素的基态原子核外电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(3)在Cu2O中Cu+原子的核外电子排布为1s22s22p63s23p63d10,处于d轨道的全满的稳定状态,而若再失去1个电子变为Cu2+时1s22s22p63s23p63d9,是不稳定的状态,CuO在高温时分解为O2和Cu2O;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个,故答案为:Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定;16;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个,故答案为:Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定;16;
(4)Cu2+与乙二胺(H2N-CH2-CH2-NH2)中N原子形成配位键;在配位体H2N-CH2-CH2-NH2中C原子与C原子之间形成非极性键;不同元素的原子之间形成极性键,所以该配离子中存在的化学键类型为配位键、极性键、非极性键,故答案为:ABD;
(5)Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键,故Fe(CO)5分子含有10个 σ键,1mol Fe(CO)5分子中含10molσ键;故答案为:10;
(6)图中结构单元底面为正六边形,边长为a cm,底面面积为6×![]() ×a cm×a cm×sin60°=
×a cm×a cm×sin60°=![]() cm2
cm2![]() ×c cm=
×c cm=![]() cm3,结构单元中含有N原子数为2,含有的Fe原子数为:12×
cm3,结构单元中含有N原子数为2,含有的Fe原子数为:12×![]() +2×
+2×![]() +3=6,该晶胞在原子总质量m=
+3=6,该晶胞在原子总质量m=![]() g=
g=![]() g,所以该晶体密度ρ=
g,所以该晶体密度ρ=![]() =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立 70 周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用如图所示的有机物X可生产S-诱抗素Y。下列说法不正确的是( )
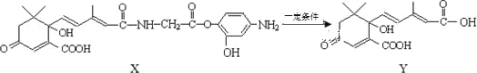
A.1mol Y 与足量 NaOH 溶液反应,最多消耗 2mol NaOH
B.Y 的分子式为 C15H19O6
C.1mol Y最多与 4mol H2 发生加成反应
D.X 可以发生氧化、取代、酯化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

根据以上工艺流程图,回答下列问题:
(1)提高焙烧效率的方法有______________________________。(写任意一种即可)
(2) “焙烧”时MoS2转化为MoO3,该反应的氧化产物是________。
(3) “碱浸”时生成CO2的电子式为________,“碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为__________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO![]() )=0.20 mol·L-1,c(SO
)=0.20 mol·L-1,c(SO![]() )=0.01 mol·L-1。“结晶”前应先除去SO
)=0.01 mol·L-1。“结晶”前应先除去SO![]() ,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO![]() 的质量分数为________%。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
的质量分数为________%。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO![]() 生成,该反应的离子方程式为__________________________。
生成,该反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
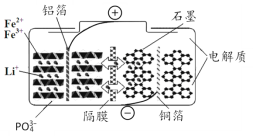
A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y两种第![]() 族元素,下列事实不能说明X的非金属性比Y强的是( )
族元素,下列事实不能说明X的非金属性比Y强的是( )
A.两种元素所形成的酸的酸性:![]()
B.两种元素所形成的气态氢化物的稳定性:![]()
C.两种元素所形成的最高价氧化物的稳定性:![]()
D.两种元素所形成的气态氢化物的还原性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,![]() 与
与![]() 可发生反应:
可发生反应:![]() 下列关于R元素的叙述中,正确的是( )
下列关于R元素的叙述中,正确的是( )
A.R位于周期表中![]() 族B.R的气态氢化物的水溶液是强酸
族B.R的气态氢化物的水溶液是强酸
C.![]() 中的R只能被还原D.
中的R只能被还原D.![]() 在常温常压下一定是气体
在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由![]() 和Fe2O3组成的混合物。进行如下实验:
和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取![]() 全部溶于
全部溶于![]() 盐酸中,固体全部溶解,得溶液C;
盐酸中,固体全部溶解,得溶液C;
③将①中得到的单质B和溶液C反应,放出![]() (标况)气体。同时生成溶液D,还残留有固体物质B;
(标况)气体。同时生成溶液D,还残留有固体物质B;
④用![]() 溶液检查时,溶液D不变色。
溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是____________,产物中的单质B是___________________。
(2)②中所发生反应的化学方程式是____________、____________。
(3)③中所发生反应的离子方程式是____________、____________。
(4)若溶液D的体积仍视为![]() ,则该溶液中
,则该溶液中![]() 为____________,
为____________,![]() 为____________。
为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物,请回答下列问题:

(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从___口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是___。
(3)能说明苯与液溴发生了取代反应的现象是___。
(4)三颈烧瓶中发生反应的化学方程式为___,反应结束后使I中的水流入II中,操作是___。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;⑤___(填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com