
【题目】2019年10月1日是中华人民共和国成立 70 周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用如图所示的有机物X可生产S-诱抗素Y。下列说法不正确的是( )
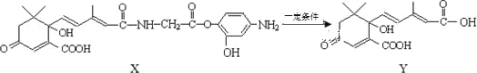
A.1mol Y 与足量 NaOH 溶液反应,最多消耗 2mol NaOH
B.Y 的分子式为 C15H19O6
C.1mol Y最多与 4mol H2 发生加成反应
D.X 可以发生氧化、取代、酯化、加聚、缩聚反应
科目:高中化学 来源: 题型:
【题目】已知断开1 mol Cl2(g)中Cl-Cl键需要吸收243 kJ能量。根据能量变化示意图,下列说法或热化学方程式正确的是

A.H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol-1
B.生成1 mol H2(g)中的H-H键放出121.5 kJ能量
C.断开1 mol HCl(g)中的H-Cl键要吸收864 kJ能量
D.HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) △H=-92.5 kJ·mol-1
Cl2(g) △H=-92.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
实验Ⅰ 配制500 mL 一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是____
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为 __,同时洗涤____(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(1)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式 ____;
②提出假设二的可能依据是_____;
③验证假设三是否成立的实验操作是____。
(2)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:
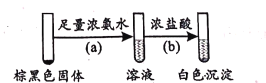
①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为____;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是____(写化学式)。
(3)由上述实验可知,盐溶液间的反应存在多样性。经验证,(1)中实验假设一成立,则(2)中实验的产物不同于(1)实验的条件是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:

①写出H2S的Ka1的表达式:___________
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是___________。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________________________。
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)

①a点所示的溶液中c(NH3·H2O)___________c(Cl-)。
②b点所示的溶液中c(Cl-)___________c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为__________。

(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
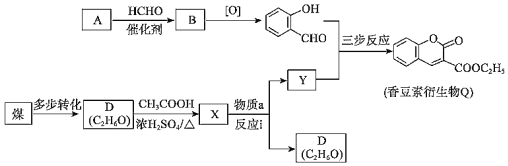
【题目】香豆素衍生物Q是合成抗肿瘤、抗凝血药的中间体,其合成路线如图。
已知:Ⅰ.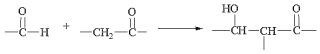
Ⅱ.RCOOR′+R″OH→RCOOR″+R′OH
(1)A的分子式为C6H6O,能与饱和溴水反应生成白色沉淀。
①按官能团分类,A的类别是_____。
②生成白色沉淀的反应方程式是_____。
(2)A→B的反应方程式是_____。
(3)D→X的反应类型是_____。
(4)物质a的分子式为C5H10O3,核磁共振氢谱有两种吸收峰,由以下途径合成:
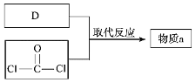
物质a的结构简式是_____。
(5)反应i为取代反应。Y只含一种官能团,Y的结构简式是_____。
(6)生成香豆素衍生物Q的“三步反应”,写出其第三步反应方程式_____。
(7)研究发现,一定条件下将香豆素衍生物Q水解、酸化生成![]() ,其水溶性增强,更有利于合成其他药物。请说明其水溶性增强的原因:_____。
,其水溶性增强,更有利于合成其他药物。请说明其水溶性增强的原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1mol·L-1氨水加水稀释后,溶液中![]() 的值减小
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)浙江大学用甲醇、CO、O2在常压、某温度和催化剂的条件下合成碳酸二甲酯(DMC)的研究开发。
已知:ⅰ. CO的燃烧热:△H=-283.0 kJmol-1;
ⅱ.1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量;
ⅲ.2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJmol-1
CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJmol-1
则2CH3OH(g)+CO (g)+ 1/2O2(g) ![]() CH3OCOOCH3 (g)+H2O(l) △H= 。该反应平衡常数K的表达式为: 。
CH3OCOOCH3 (g)+H2O(l) △H= 。该反应平衡常数K的表达式为: 。
(2)甲醇也是制备甲酸的一种重要原料。某温度时,将10mol甲酸钠溶于水,溶液显碱性,向该溶液中滴加1L某浓度的甲酸,使溶液呈中性,则滴加甲酸的过程中水的电离平衡将_____________(填“正向”、“逆向”或“不”) 移动, 此中性溶液中离子浓度由大到小的顺序为: 。
Ⅱ.甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
(1)在恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是 (选填编号)。
A.2v正(CH3OH)=v逆(CO2) B.CH3OH与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变
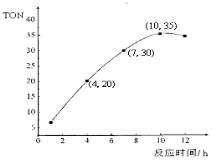
(2)某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。在该温度下,最佳反应时间是 ;4~10 h内碳酸二甲酯的平均反应速率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过__________方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
![]()
该配离子中含有的化学键类型有_______________(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含_____________mol σ键。
(6)某种磁性氮化铁的结构如图所示

N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为______g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___________,![]() 能级上的未成对电子数为________。
能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成![]() 蓝色溶液。
蓝色溶液。
①![]() 中阴离子的立体构型是_______。
中阴离子的立体构型是_______。
②在![]() 中
中![]() 与
与![]() 之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
③氨的沸点__________(填“高于”或“低于”)膦(![]() ),原因是_____________;氨是__________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__________。
),原因是_____________;氨是__________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com