
【题目】根据下面的信息,下列叙述正确的是( )

A. 2molH2(g)跟1molO2(g)反应生成2molH2O(g)吸收能量为490kJ
B. 1molH2(g)跟0.5molO2(g)反应生成1molH2O(l)吸收能量为245kJ
C. 2molH2O(g)的能量比2molH2(g)与1molO2(g)的能量之和低
D. 化学反应中能量变化的大小与反应物的质量多少无关
【答案】C
【解析】
A、根据图示,2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出490kJ热量[(930-436-249)![]() ]kJ,选项A错误;
]kJ,选项A错误;
B、由于气态水转化为液态时释放能量,则1molH2(g)和0.5molO2(g)反应生成1molH2O(l),放出热量大于245kJ,选项B错误;
C、2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出490kJ的热量,故2molH2O(g)的能量比2molH2(g)与1molO2(g)的能量之和低,选项C正确;
D.化学反应中的能量变化的大小与反应物的质量成正比,选项D错误;
答案选C。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180g)是一种浅黄色晶体, 难溶于水,受热分解(文献显示其反应方程式为FeC2O4·2H2O ==FeO+CO↑+CO2↑+2H2O)。某化学兴趣小组设计如图装置,探究草酸亚铁晶体的分解反应。
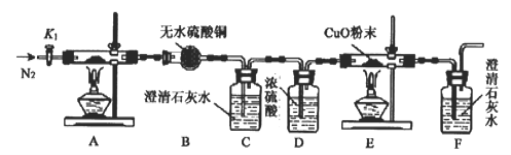
(1)该装置存在的明显缺陷为________________。
(2)设计实验步骤如下:①检查装置的气密性;②打开活塞K1,通入一段时间的N2,再关闭活塞K1;③先点燃_____处的酒精灯,再点燃________处的酒精灯。
(3)实验过程中,证明分解生成CO2的现象是_________________;而E处黑色粉末变红,证明草酸亚铁分解产中CO,若只通过F中的现象证明产生CO,则需要在C和D之间增加盛有_______溶液的洗气瓶。
(4)实验结束后,有同学打开K1,又通入一段时间的N2,使装置A中分解产生的气体全部通入后面的装置中,并将装置C、F中的沉淀过滤、洗涤、干燥、称量,测得C中沉淀质量大约是F中的3倍,重新实验得出的实验结果不变。小组成员经过讨论排除澄清石灰水不足造成的影响,提出三个假设:
a.CO在装置E中没有完全氧化;
b.使用的草酸亚铁试剂变质,有部分CO被分解过程中产生的Fe2O3氧化为CO2;
c.草酸亚铁分解时,有部分CO被FeO氧化为CO2;
小组成员于是设计如下方案验证:
①验证假设a:在E之后再增加一个相同装罝E,并增加E中CuO的量,重新实验,所得数据只有微小变化,但不足以影响实验结果,说明假设a不成立。
②验证假设b:取少量草酸亚铁晶体溶于盐酸,再加入适量的____溶液,无明显现象,证明草酸亚铁晶体没有变质,说明假设b不成立
③验证假设c:取实验后A中固体溶于盐酸,产生__________,证明假设c成立。
④实验时同时测出下列有关数据:FeC2O4·2H2O的质量为10.80g,A中剩余固体的质量为3.84g,测得实验结束后装置A中n(FeO)=________。
(5)根据实验分析,写出装置A中发生的总反应方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子。有关判断不正确的是
( )
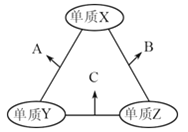
A. A不能溶解于B中
B. X元素位于ⅥA族
C. B的沸点高于C的沸点
D. A和C不可能发生氧化还原反应,X与Y能形成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 22.4LN2含阿伏加德罗常数个氮分子
B. 在标准状况下,22.4L水的质量约为18g
C. 22g二氧化碳与标准状况下11.2LHCl含有相同的分子数
D. 在同温同压下,相同体积的任何气体单质所含的原子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
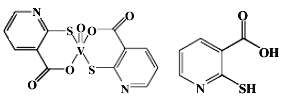
【题目】硫、钒、钴、铂、镧的相关化合物,在药物化学及催化化学等领城应用广泛。回答下列问题:
(1)基态钒原子的电子排布式为__________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______.VO43—的几何构型为_________。
(2)2-巯基烟酸氧钒配合物(分子结构如图)是副作用小的有效调节血糖的新型药物。
①该药物中硫原子的杂化方式是_______.所含第二周期元素第一电离能由大到小的排列顺序为_____________。
②2-巯基烟酸(分子结构如图)水溶性优于2-巯基烟酸氧钒配合物的原因是___________________。
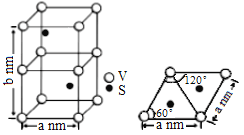
(3)某六方硫钒化合物晶体的晶胞如图所示,该晶胞的化学式为______。为该晶胞俯视图,该晶胞的密度为_____g·cm-3(NA为阿伏加德罗常数的数值.列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是( )
A.氨水B.硝酸银溶液C.Na2SO4溶液D.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g) == H2(g) + I2(g)的ΔH= +11 kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为
A.576 kJB.283 kJC.598 kJ·D.299 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应:I2(g)+H2(g)![]() 2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 反应速率 |
(1) | 升高温度 | ______ |
(2) | 加入正催化剂 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 将容器的容积扩大到原来的2倍 | ______ |
(5) | 保持容积不变,通入b mol Ne | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA
B. 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA
D. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com