
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180g)是一种浅黄色晶体, 难溶于水,受热分解(文献显示其反应方程式为FeC2O4·2H2O ==FeO+CO↑+CO2↑+2H2O)。某化学兴趣小组设计如图装置,探究草酸亚铁晶体的分解反应。
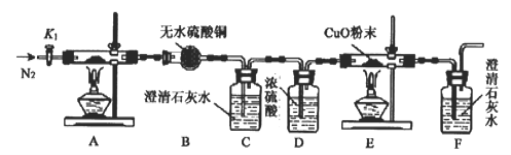
(1)该装置存在的明显缺陷为________________。
(2)设计实验步骤如下:①检查装置的气密性;②打开活塞K1,通入一段时间的N2,再关闭活塞K1;③先点燃_____处的酒精灯,再点燃________处的酒精灯。
(3)实验过程中,证明分解生成CO2的现象是_________________;而E处黑色粉末变红,证明草酸亚铁分解产中CO,若只通过F中的现象证明产生CO,则需要在C和D之间增加盛有_______溶液的洗气瓶。
(4)实验结束后,有同学打开K1,又通入一段时间的N2,使装置A中分解产生的气体全部通入后面的装置中,并将装置C、F中的沉淀过滤、洗涤、干燥、称量,测得C中沉淀质量大约是F中的3倍,重新实验得出的实验结果不变。小组成员经过讨论排除澄清石灰水不足造成的影响,提出三个假设:
a.CO在装置E中没有完全氧化;
b.使用的草酸亚铁试剂变质,有部分CO被分解过程中产生的Fe2O3氧化为CO2;
c.草酸亚铁分解时,有部分CO被FeO氧化为CO2;
小组成员于是设计如下方案验证:
①验证假设a:在E之后再增加一个相同装罝E,并增加E中CuO的量,重新实验,所得数据只有微小变化,但不足以影响实验结果,说明假设a不成立。
②验证假设b:取少量草酸亚铁晶体溶于盐酸,再加入适量的____溶液,无明显现象,证明草酸亚铁晶体没有变质,说明假设b不成立
③验证假设c:取实验后A中固体溶于盐酸,产生__________,证明假设c成立。
④实验时同时测出下列有关数据:FeC2O4·2H2O的质量为10.80g,A中剩余固体的质量为3.84g,测得实验结束后装置A中n(FeO)=________。
(5)根据实验分析,写出装置A中发生的总反应方程式_____________________。
【答案】没有处理尾气中的CO气体,会造成大气污染(或没有尾气处理装置) E A C中澄清石灰水变浑浊 NaOH KSCN 或NH4SCN 气体 0.03 FeC2O4·2H2O ![]() Fe+FeO+CO↑+3CO2↑+2H2O
Fe+FeO+CO↑+3CO2↑+2H2O
【解析】
根据实验步骤可知,检查装置的气密性后,打开活塞K1,通入一段时间的N2,目的是排除装置中的空气,再关闭活塞K1,先点燃E处酒精灯,再点燃A处酒精灯,装置A中发生FeC2O4·2H2O的分解反应,装置B中无水硫酸铜可以检验是否有水蒸气生成,装置C中澄清石灰水可以检验并吸收生成的二氧化碳,装置D中的浓硫酸可以干燥气体,装置E,通过现象可以验证是否生成还原性气体,装置F中澄清石灰水可以检验前面的还原性气体是否为一氧化碳,据此分析解答。
(1)从环保角度考虑,该套实验装置的明显缺陷是没有处理尾气.没有处理尾气中的CO气体,会造成大气污染,故答案为:没有处理尾气中的CO气体,会造成大气污染;
(2)实验步骤如下:①检查装置的气密性;②打开活塞K1,通入一段时间的N2,再关闭活塞K1;③先点燃E处酒精灯,再点燃A处酒精灯,更好的检验一氧化碳气体的存在,故答案为:E;A;
(3)实验过程中,证明分解生成CO2的现象是C中澄清石灰水变浑浊,而E处黑色粉末变红,证明草酸亚铁分解产中CO,若只通过F中的现象证明产生CO,则需要在C和D之间增加盛有NaOH溶液的洗气瓶,用来除净生成的二氧化碳气体,故答案为:C中澄清石灰水变浑浊;NaOH;
(4)②验证假设b:取少量草酸亚铁晶体溶于盐酸,再加入适量的KSCN 或NH4SCN溶液,无明显现象,证明草酸亚铁晶体没有变质,说明假设b不成立,
③验证假设c:草酸亚铁分解时,有部分CO被FeO氧化为CO2,反应过程中有Fe生成,取实验后A中固体溶于盐酸,产生气体,说明生成了铁,证明假设c成立,
④分析可知晶体分解生成的产物为二氧化碳、一氧化碳、水、氧化亚铁、铁,反应后固体为铁和亚铁,实验时同时测出下列有关数据:FeC2O42H2O的质量为10.80g,其物质的量n=![]() =0.06mol,A中剩余固体的质量为3.84g,设生成Fe物质的量为x,FeO物质的量为y。则有x+y=0.06mol,56x+72y=3.84g,解得:x=0.03mol,y=0.03mol,即测得实验结束后装置A中n(FeO)=0.03mol,故答案为:KSCN或NH4SCN;气体;0.03;
=0.06mol,A中剩余固体的质量为3.84g,设生成Fe物质的量为x,FeO物质的量为y。则有x+y=0.06mol,56x+72y=3.84g,解得:x=0.03mol,y=0.03mol,即测得实验结束后装置A中n(FeO)=0.03mol,故答案为:KSCN或NH4SCN;气体;0.03;
(5)实验分析可知晶体分解生成的产物为二氧化碳、一氧化碳、水、氧化亚铁、铁,反应后固体为铁和亚铁,测得C中沉淀质量大约是F中的3倍,碳元素守恒说明二氧化碳物质的量是一氧化碳物质的量的3倍,反应的化学方程式为:FeC2O42H2O![]() Fe+FeO+CO↑+3CO2↑+2H2O,故答案为:FeC2O42H2O
Fe+FeO+CO↑+3CO2↑+2H2O,故答案为:FeC2O42H2O![]() Fe+FeO+CO↑+3CO2↑+2H2O。
Fe+FeO+CO↑+3CO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】在5L的密闭容器中进行以下反应:4NH3+5O2=4NO+6H2O,半分钟后冷却至室温,测得NO的物质的量增加了0.3mol,则此反应的平均反应速率υ(X)为( )
A. υ(H2O)=0.12mol·L-1·min-1B. υ(O2)=0.30mol·L-1·min-1
C. υ(NO)=0.008mol·L-1·s-1D. υ(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述错误的是
①18 g金刚石中,碳碳共价键数为3NA
②1mol铜与足量硫蒸气反应,转移电子数为 NA
③常温常压时S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
④一定温度下,1 L 0.50 mol·L━1NH4Cl溶液与2 L 0.25mol·L━1NH4Cl溶液中NH4+的物质的量均小于0.5NA,且前者更少
⑤电解法精炼铜时,当阳极质量减少64g时,电路中通过的电子数一定为2NA
A. ② B. ②④⑤ C. ④⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。
![]()
下列说法中错误的是( )
A. ①、②中除加试剂外,还需要进行过滤操作
B. 加热蒸干b溶液能得到原溶质
C. ③中需要通入过量的NH3
D. ④进行的操作是加热,而且d一定是Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知磷酸分子(![]() )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
A. H3 PO2属于三元酸 B. H3 PO2的结构式为
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
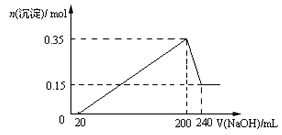
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )

A. 2molH2(g)跟1molO2(g)反应生成2molH2O(g)吸收能量为490kJ
B. 1molH2(g)跟0.5molO2(g)反应生成1molH2O(l)吸收能量为245kJ
C. 2molH2O(g)的能量比2molH2(g)与1molO2(g)的能量之和低
D. 化学反应中能量变化的大小与反应物的质量多少无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com