
科目:高中化学 来源: 题型:阅读理解
| 温度℃ 溶解度 溶质 g/100g水 |
10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
查看答案和解析>>
科目:高中化学 来源: 题型:
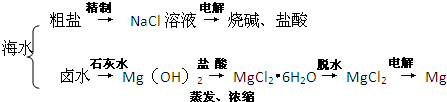
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市高三上学期期中考试化学试卷 题型:选择题
如右图,电解用粗盐(含Mg2+、Ca2+、SO42¯等杂质)配制的食盐水,以下说法正确的是( )

A.a是电解池的阳极
B.b电极上发生还原反应
C.a电极附近有白色沉淀出现
D.b电极上有无色气体产生
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
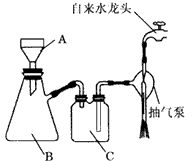
(17分)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是 。
装置B在分液时为使液体顺利下滴,应进行的具体操作是
。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
 |
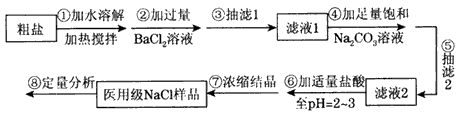
问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;
④调节溶液的pH等于7; ⑤溶解; ⑥过滤; ⑦蒸发。
正确的操作顺序是_____________(填写序号字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的离子方程式是
。
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是 (从给定的四种装置中选择)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com