
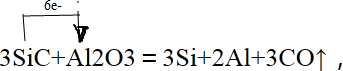 .
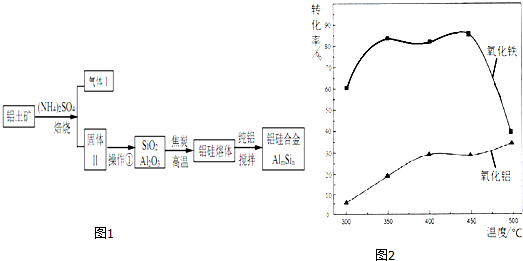
.分析 铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加硫酸铵焙烧,Fe2O3转化为NH4Fe(SO4)2同时生成氨气,加水溶解、过滤,滤渣为SiO2和Al2O3,用焦炭在高温条件下还原SiO2、Al2O3得到硅铝熔体,在加纯铝搅拌,得到硅铝合金;
(1)Al、Fe形成原电池,活泼性强的做负极;
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,所以 Fe2O3发生反应的方程式:4(NH4)2SO4+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2NH4Fe(SO4)2+3H2O+6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在300℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为300℃;(3)溶液中含有铝离子与氢氧根离子生成偏铝酸根离子;
(4)在高温条件下,SiC与Al2O3反应生成Al和CO;
(5)因为Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38,所以向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,首先铁离子先沉淀,铁离子全部沉淀后,铝离子开始沉淀,再滴加氢氧化钠氢氧化铝溶解,根据此分析解答.
解答 解:(1)Al、Fe形成原电池,Al活泼性比Fe强的做负极,被腐蚀,所以铝硅合金材料中若含铁,容易发生电化学腐蚀;
故答案为:铁与铝形成原电池,加快了铝的腐蚀;
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,所以 Fe2O3发生反应的方程式:4(NH4)2SO4+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2NH4Fe(SO4)2+3H2O+6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在300℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为300℃;
故答案为:4(NH4)2SO4+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2NH4Fe(SO4)2+3H2O+6NH3↑;300℃;
(3)溶液中含有铝离子与氢氧根离子生成偏铝酸根离子,其反应的离子方程式为:Al3++4OH-=AlO2-+2H2O;
故答案为:Al3++4OH-=AlO2-+2H2O;
(4)在高温条件下,SiC与Al2O3反应生成Al和CO,其反应的方程式为: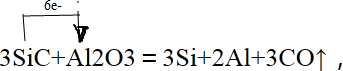 故答案为:
故答案为: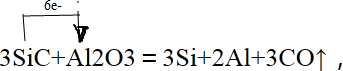 ;
;
(5)当两种沉淀共存时,由于Ksp[Al(OH)3]=c(Al3+)•c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),所以c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=2.5×104,故答案为:2.5×104.
点评 本题考查了物质分离和提纯基本操作,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若G的最高价氧化物水化物为强酸,则J一定是活泼非金属元素 | |
| B. | HnJOm为强酸,则G是位于VA族以后的活泼非金属元素 | |
| C. | 若T的最低化合价为-3,则G的最高正化合价为+6 | |
| D. | 若M的最高正化合价为+4,则五种元素不一定都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不随时间变化而变化 | |
| B. | 气体总物质的量不随时间变化而变化 | |
| C. | 2v正(B)=v逆(D) | |
| D. | 混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4和Na2O2都属于碱性氧化物 | B. | KOH和Na2CO3都属于碱 | ||
| C. | NaHSO4和NaHCO3都属于酸式盐 | D. | Na2O和Al2O3都属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气 | |
| B. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 | |
| C. | 滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3. | |
| D. | 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
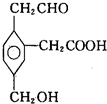 某有机物的结构简式如图所示,在一定条件下对于下列反应:
某有机物的结构简式如图所示,在一定条件下对于下列反应:| A. | ②③④ | B. | ①③④⑤ | C. | ①③⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com