
(8分)化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
实例 | 影响条件 |
①食物放在冰箱里能延长保质期 | 温度(示例) |
②实验室将块状药品研细,再进行反应 | ____________ |
③用H2O2分解制O2时,加入MnO2 | ____________ |
④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |
(2)一定温度下,在2L体积不变的密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示:

①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
(1)②反应物表面积; ③催化剂; ④反应物浓度。
(2)①X(g)+Y(g) 2Z(g); ②0.079 ; ③ 29 ;④等于。
2Z(g); ②0.079 ; ③ 29 ;④等于。
【解析】
试题分析:(1)②实验室将块状药品研细,再进行反应,是为了扩大反应物表面积,加快化学反应速率;③用H2O2分解制O2时,加入MnO2的作用是作催化剂,提高化学反应速率;④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气,是为了增大反应物浓度,使化学平衡正向移动,提高SO2转化率。(2)①根据图像可知该反应的化学方程式是X(g)+Y(g) 2Z(g);②从反应开始到10 s,用Z表示的反应速率为v(Z)=Δc(Z)÷Δt=1.58mol÷2L÷10 s=0.079mol/(L·s)。③该反应的化学平衡常数为K
2Z(g);②从反应开始到10 s,用Z表示的反应速率为v(Z)=Δc(Z)÷Δt=1.58mol÷2L÷10 s=0.079mol/(L·s)。③该反应的化学平衡常数为K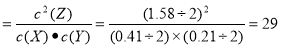 。④由于反应进行到10s时就已经达到平衡,当反应进行到15 s时,向密闭容器中通入氩气,此时若外界条件不变化,则平衡不变,速率也不变,所以用Z表示的反应速率等于10 s时用Z表示的反应速率。
。④由于反应进行到10s时就已经达到平衡,当反应进行到15 s时,向密闭容器中通入氩气,此时若外界条件不变化,则平衡不变,速率也不变,所以用Z表示的反应速率等于10 s时用Z表示的反应速率。
考点:考查外界条件对化学反应的快慢和限度的影响的知识。


科目:高中化学 来源:2013-2014江苏省南京市雨花区高一下学期期末考试化学试卷(解析版) 题型:填空题
(2分)冶炼金属的三种常用方法是:①热分解法 ②热还原剂法 ③电解法。人类用量处在前三位的金属是铁、铝、铜。(填编号)
(1)冶炼铝用到的方法是 ;
(2)冶炼铁和铜的常用方法是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏宿迁市高一下学期期末测试化学试卷(解析版) 题型:选择题
与22gCO2所含分子数相等的水的质量为( )
A.44g B.22g C.18g D.9g
查看答案和解析>>
科目:高中化学 来源:2013-2014广西贵港市毕业班5月高考冲刺模拟理综化学试卷(解析版) 题型:选择题
下列实验操作不能达到预期的目的的是
| 实验目的 | 操作 |
A | 证明CH2=CHCH2OH中含有碳碳双键 | 滴入溴水 |
B | 欲证明浓硫酸有脱水性和强氧化性 | 将浓硫酸滴到蔗糖上 |
C | 证明FeCl2溶液中含有Fe2+ | 加入酸性KMnO4溶液 |
D | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:填空题
(5分)H2可以催化还原NO以达到消除污染的目的:
(1)已知:①

②

则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为: ________________。
(2)一定条件下,在体积为2 L的容器中通入1 mol H2和l mol NO气体生成N2(g)和H2O(l),该反应达平衡时,容器内的压强是反应起始时的40%。保持其它条件不变,只往容器中再通入1 mol H2,计算反应再达新平衡时,化学平衡常数为__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据电镀原理,钢芯镀镍时,钢芯应该做
A.正极 B.负极 C.阳极 D.阴极
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:选择题
在673K、30MPa下,在密闭容器中进行合成氨反应: N2(g)+3H2(g) 2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
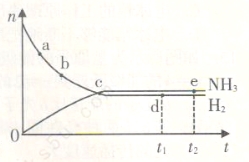
A、正反应速率:a点小于b点
B、c点处反应达到平衡
C、d点和e点处的n(N2)不一样
D、若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质性质的描述和该性质的应用均正确的是( )
| A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏 |
| B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 |
| C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气 |
| D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com