
| ����Ũ��(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
 CH3COO- + H+ ��2�֣�
CH3COO- + H+ ��2�֣� CH3COO- + H+
CH3COO- + H+ 

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �� | ���볣�� |
| ̼�� | K1��4��10��7 K2��5.6��10��11 |
| ������ | K1��1.54��10��2 K2��1.02��10��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H++SO42-��
H++SO42-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��60��ʱ��NaCl��Һ��pH<7������Һ������ |
| B����pH��4��CH3COOH��Һ��ˮϡ�ͣ���Һ���������ӵ�Ũ�Ⱦ���С |
| C�������£�CH3COOH���ӿ��ܴ�����pH>7�ļ�����Һ�� |
| D����ͬ�¶��£�1 mol��L��1��ˮ��0��5 mol��L��1��ˮ��c(OH��)֮����2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ�У���ˮ�����������������Ũ�Ⱦ�Ϊ1��10��11mol/L |
| B���ֱ��ˮϡ��100����������Һ��pH����Ϊ9 |
| C����ˮ�е�c(NH+)��Ba(OH)2��Һ�е�c(Ba2+)��� |
| D���ֱ���������pHΪ1�����ᣬ���ߵĵ�����������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ���䣻��OH�C��Ŀ����H+��Ŀ��С����pH���� c(H+)��c(OH�C)�ij˻���С
���䣻��OH�C��Ŀ����H+��Ŀ��С����pH���� c(H+)��c(OH�C)�ij˻���С| A���٢ڢ� | B���٢ݢ� | C�������ⶼ��ȷ | D���٢ܢݢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��� | ����(��) | ����Ȧ� |
| A | ������Һ(��һ����ȫ����)�� �ڶ��� HSO4- H����SO42- H����SO42- | 10% |
| B | ����������Һ�� HSO4- H����SO42 H����SO42 | 29% |
| C | ��� CH3COOH CH3COO����H�� CH3COO����H�� | 1.33% |
| D | ��� HCl��H����Cl�� | 100% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ʼ��Ӧʱ�����ߵ�������� | B������ų���H2�� |
| C�����߷ų���H2һ���� | D���������ĵ�Zn�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
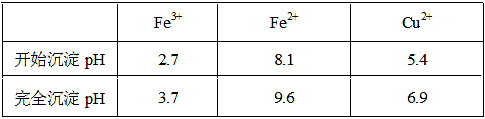
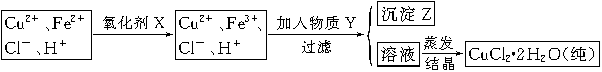
| A��NaClO | B��H2O2 | C��KMnO4 | D��HNO3 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com