
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- | 10% |
| B | 硫酸氢钠溶液: HSO4- H++SO42 H++SO42 | 29% |
| C | 醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D | 盐酸: HCl=H++Cl- | 100% |
科目:高中化学 来源:不详 题型:单选题
| A.溶液中导电粒子的数目减少 |
B.溶液中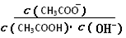 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH <7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol/L氢氰酸溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.HCN溶液的导电性一定比强酸溶液的导电性弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K(HF)=7.2×10-4 |
| B.K(HCN)<K(HNO2)<K(HF) |
| C.根据①③两个反应即可知三种酸的相对强弱,相同条件下HCN的酸性最弱 |
| D.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaA溶液的pH>7(室温下) |
| B.pH试纸显示0.1 mol/L HA溶液的pH为2~3(室温下) |
| C.0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强 |
| D.HA溶液能与CH3COONa溶液反应生成CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com