
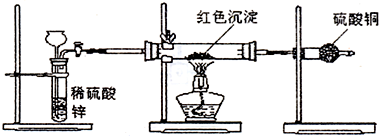
(10)为比较铜与锌的金属活动性相对强弱,甲、乙、丙三位同学用中学化学常见的药品和仪器(用品),设计了下列实验。试回答下列问题:
(1)甲同学将锌插入CuSO4溶液中,结果锌片的表面析出一层红色的物质,该反应的离子方程式为 。
(2)乙同学将铜片和锌片插入同一个盛有稀H2SO4的烧杯中(铜片和锌片不接触),观察到的现象是
(3)丙同学接着乙同学的实验,用导线将铜片和锌片连接起来组成原电池,此时作电池正板的是 ,负极的电板反应式为
(4)甲、乙、丙三位同学所设计的实验中能达到比较铜和锌的金属活动性相对强弱的实验目的的是 (填字母)。
| A.只有甲同学 | B.甲和乙同学 |
| C.乙和丙同学 | D.甲,乙和丙同学 |
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(10)为比较铜与锌的金属活动性相对强弱,甲、乙、丙三位同学用中学化学常见的药品和仪器(用品),设计了下列实验。试回答下列问题:
(1)甲同学将锌插入CuSO4溶液中,结果锌片的表面析出一层红色的物质,该反应的离子方程式为 。
(2)乙同学将铜片和锌片插入同一个盛有稀H2SO4的烧杯中(铜片和锌片不接触),观察到的现象是
(3)丙同学接着乙同学的实验,用导线将铜片和锌片连接起来组成原电池,此时作电池正板的是 ,负极的电板反应式为
(4)甲、乙、丙三位同学所设计的实验中能达到比较铜和锌的金属活动性相对强弱的实验目的的是 (填字母)。
A、只有甲同学 B、甲和乙同学
C、乙和丙同学 D、甲,乙和丙同学
查看答案和解析>>
科目:高中化学 来源:2014届湖北省高一下学期期中考试化学试卷(解析版) 题型:填空题
(10)为比较铜与锌的金属活动性相对强弱,甲、乙、丙三位同学用中学化学常见的药品和仪器(用品),设计了下列实验。试回答下列问题:
(1)甲同学将锌插入CuSO4溶液中,结果锌片的表面析出一层红色的物质,该反应的离子方程式为 。
(2)乙同学将铜片和锌片插入同一个盛有稀H2SO4的烧杯中(铜片和锌片不接触),观察到的现象是
(3)丙同学接着乙同学的实验,用导线将铜片和锌片连接起来组成原电池,此时作电池正板的是 ,负极的电板反应式为
(4)甲、乙、丙三位同学所设计的实验中能达到比较铜和锌的金属活动性相对强弱的实验目的的是 (填字母)。
A、只有甲同学 B、甲和乙同学
C、乙和丙同学 D、甲,乙和丙同学
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com