
| A. | 2O3$\frac{\underline{\;催化剂\;}}{\;}$ 3O2 | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | |
| C. | 3C12+2Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl3 | |
| D. | 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ |
分析 四种基本反应类型有:化合反应、分解反应、置换反应、复分解反应;有元素化合价变化的反应属于氧化还原反应.
解答 解:A、反应2O3$\frac{\underline{\;催化剂\;}}{\;}$ 3O2不属于四种基本反应类型的反应,也不是氧化还原反应,故A错误;
B、2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe是置换反应,是氧化还原反应,故B错误;
C、3C12+2Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl3是化合反应,是氧化还原反应,故C错误;
D、2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑不属于四种基本反应类型,属于氧化还原反应,故D正确.
故选D.
点评 本题考查氧化还原反应与四种基本反应类型的关系,明确有元素化合价变化的反应属于氧化还原反应即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大,主要原因是增加了反应物分子浓度 | |
| D. | 使用正催化剂能增大活化分子百分数,从而显著地增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与阿伏加德罗常数(NA)个磷酸分子的质量在数值上相等 | |
| B. | 常温常压下,0.5NA个CO分子所占体积是11.2L | |
| C. | 1molNH4+中含有的电子数为10NA | |
| D. | 1L0.3mol/L的Na2SO4溶液中,含有Na+和 SO42-总数为0.9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| C. | 用蒸发结晶的方法从氧化后的海带灰浸取液中提取碘--蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物都是酸性氧化物 | |
| B. | CaCO3是电解质,但CaCO3的水溶液几乎不导电 | |
| C. | 金属Al是非电解质,但金属Al能导电 | |
| D. | H2SO4(纯)是电解质,因此H2SO4(纯)能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
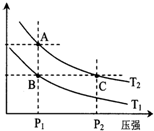 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质 或结 构信息 | 原子核外有两个电子层,最外层有3个未成对电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为:[Ar]3 d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中一种是冶炼金属工业的常用还原剂 |
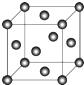 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com