
【题目】下列说法正确的是( )
A. 不同核素的质量数必定不同
B. 互为同位素的原子,其质子数必定相等
C. 32S、33S具有不同的电子数
D. 核外电子数相同的微粒必定属于同一种元素
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O![]() NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是
NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是

A. 曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+
B. 曲线Ⅰ与曲线II相交点对应pH=6.85
C. 0.1 mol ·L-1H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-)
D. 乙二胺在水溶液中第二步电离的方程式H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-
[H3NCH2CH2NH3]2++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:

(1)对青蒿干燥破碎后,加入乙醚的目的是______。
(2)操作Ⅰ需要的玻璃仪器主要有烧杯、______,操作Ⅱ的名称是______。
(3)操作Ⅲ的主要过程可能是______(填字母)。
A. 加水溶解,蒸发浓缩、冷却结晶B. 加95%的乙醇,浓缩、结晶、过滤C. 加入乙醚进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置(气密性良好),若先将甲中液体滴入丙中,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体滴入丁中,气球又明显鼓起。下列组合正确的是( )

选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
A | 双氧水 | 二氧化锰 | 水 | 氢氧化钙 |
B | 稀硫酸 | 镁 | 盐酸 | 碳酸钙 |
C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
D | 水 | 氧化钙 | 盐酸 | 镁 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是

A. 电解过程中,d电极质量增加 B. 电解过程中,氯离子浓度不变
C. a为负极,b为正极 D. a为阳极,b为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是( )
A. 加入催化剂有利于合成氨的反应
B. 由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深
C. 500 ℃时比室温更有利于合成氨的反应
D. 将混合气体中的氨液化有利于合成氨反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中不能用勒夏特列原理解释是
A. 由H2、I2(g)、HI(g)气体组成的平衡体系压缩体积后颜色变深
B. 实验室常用排饱和食盐水法收集氯气
C. 红棕色的NO2,加压后颜色先变深后变浅
D. 工业制取金属钾[Na(l)+KCl(l)![]() NaCl(l)+ K(g)]时,使K变成蒸气从混合体系中分离出来
NaCl(l)+ K(g)]时,使K变成蒸气从混合体系中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:
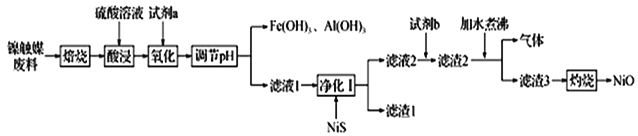
已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com