
����Ŀ��������δ���dz��������Դ����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ�������(TiO2)��������ʹ��ˮ�ֽ�õ��������¼�����2H2O![]() 2H2+O2���Ƶõ�����������ȼ�ϵ�ء��ϳɰ���ҵ���ش��������⣺
2H2+O2���Ƶõ�����������ȼ�ϵ�ء��ϳɰ���ҵ���ش��������⣺
(1)�ֽ⺣ˮʱ��________��ת��Ϊ________�ܡ����ɵ���������ȼ�ϵ��ʱ��________��ת��Ϊ________�ܡ�
(2)ij������ȼ�ϵ������NaOH��Һ������ʣ������ĵ缫��ӦʽΪ________������ȼ�ϸ�Ϊ���飬�����ĵ缫��ӦʽΪ________��
(3)���������ںϳɰ���һ���¶��£���2L ���ܱ������м���1 molN2�� 3molH2������Ӧ N2(g)+3H2(g)![]() 2NH3(g)��2minʱ���N2��Ũ��Ϊ0.3mol/L��5minʱ�ﵽƽ�⣬��ʱ���ѹǿΪ��ʼʱ��
2NH3(g)��2minʱ���N2��Ũ��Ϊ0.3mol/L��5minʱ�ﵽƽ�⣬��ʱ���ѹǿΪ��ʼʱ��![]() ����ǰ2min��NH3��ʾ�Ļ�ѧ��Ӧ����Ϊ________��ƽ��ʱ��N2��ת����Ϊ________����������ƽ����Է�������Ϊ________��
����ǰ2min��NH3��ʾ�Ļ�ѧ��Ӧ����Ϊ________��ƽ��ʱ��N2��ת����Ϊ________����������ƽ����Է�������Ϊ________��
���𰸡�̫�� ��ѧ ��ѧ ���� O2+4e-+2H2O=4OH- CH4-8e-+10OH-=CO32-+7H2O 0.2mol/(L��min) 50% 11.3
��������
(1)����ͼ��֪��̫���ܲ����ļ���ֽ�ˮ����������������̫����ת��Ϊ���ܡ�����ת��Ϊ��ѧ�ܣ����ɵ���������ȼ�ϵ�أ��ǽ���ѧ��ת��Ϊ���ܣ�
(2)������ȼ�ϼ��Ե���У�������O2�õ��Ӻ�ˮ��Ӧ����OH-�������������ȼ�ϣ������Ǽ���ʧ���Ӻ�OH-��Ӧ����CO32-���Ӻ�H2O��
(3)�ȸ��ݻ�ѧ��Ӧ���ʵĺ�����㵪���ķ�Ӧ���ʣ�Ȼ�������ò�ͬ���ʱ�ʾ�ķ�Ӧ���ʵĹ�ϵ������H2��ʾ�ķ�Ӧ���ʣ�������ת���ʵ��ڷ�Ӧת���ĵ��������ʵ���ռ�����ʵ����İٷֱȼ��㣻�����ں��º��������£��������ʵ���֮�ȵ�����ѹǿ֮�ȣ�����ƽ��ʱ������������ʵ��������û��������������������������ʵ����õ���������ƽ��Ħ���������ٽ�ϻ������ƽ����Է�����������ֵ�ϵ�����ƽ��Ħ�����������û�������ƽ����Է���������
(1)����ͼ֪��̫���ܲ����ļ���ֽ�ˮ����������������̫����ת��Ϊ���ܡ�����ת��Ϊ��ѧ�ܣ����ɵ���������ȼ�ϵ�أ��ǽ���ѧ��ת��Ϊ���ܣ����Էֽ⺣ˮʱ��̫������ת��Ϊ��ѧ�ܡ����ɵ���������ȼ�ϵ��ʱ����ѧ����ת��Ϊ���ܣ�
(2)������ȼ�ϼ��Ե���У�������O2�õ��Ӻ���Һ�е�ˮ��Ӧ����OH-���������ĵ缫��ӦʽΪO2+4e-+2H2O=4OH-�������CH4��ȼ�ϣ�����CH4ʧ���Ӻ���Һ�е�OH-��Ӧ����CO32-��ˮ���缫��ӦʽΪ CH4-8e-+10OH-=CO32-+7H2O��
(3)��Ӧ��ʼʱc(N2)=![]() =0.5mol/L��c(H2)=
=0.5mol/L��c(H2)=![]() =1.5mol/L��2minʱ���N2��Ũ��Ϊ0.3mol/L����ǰ2min��N2��ʾ�Ļ�ѧ��Ӧ����v(N2)=
=1.5mol/L��2minʱ���N2��Ũ��Ϊ0.3mol/L����ǰ2min��N2��ʾ�Ļ�ѧ��Ӧ����v(N2)=![]() =0.1mol/(Lmin)��
=0.1mol/(Lmin)��
ǰ2min��v(NH3)=2v(N2)=2��0.1 mol/(Lmin) =0.2 mol/(Lmin)��
�ں��º��������£��������ʵ���֮�ȵ�����ѹǿ֮�ȣ���ƽ��ʱ������������ʵ���Ϊ(1+3)mol��![]() =3mol�����ݷ���ʽ֪��N2+3H2
=3mol�����ݷ���ʽ֪��N2+3H2![]() 2NH3��֪����Ӧǰ����ٵ����ʵ����൱�ڲμӷ�Ӧ������2������μӷ�Ӧ��n(N2)=
2NH3��֪����Ӧǰ����ٵ����ʵ����൱�ڲμӷ�Ӧ������2������μӷ�Ӧ��n(N2)=![]() mol=0.5mol������ת����=
mol=0.5mol������ת����= ��100%=
��100%=![]() ��100%=50%���������������=1mol��28g/mol+3mol��2g/mol=34g���������ƽ����Է�����������ֵ�ϵ�����ƽ��Ħ������=
��100%=50%���������������=1mol��28g/mol+3mol��2g/mol=34g���������ƽ����Է�����������ֵ�ϵ�����ƽ��Ħ������=![]() =
=![]() =11.3g/mol������ƽ����Է�������Ϊ11.3��
=11.3g/mol������ƽ����Է�������Ϊ11.3��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A.���ڳ����¾����ױ�����B.�����Ⱥ��ܹ��Ż�ȼ��
C.���ڿ����л�����������ȼD.����������ȼ�ո�Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳƷ���Ӽ��У���ʹ��Ŀ���뷴Ӧ�����йص��ǣ� ��
A.������B.��ζ��C.��ɫ��D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�������ʵ�ı�������ȷ����
A. ����ˮ��Ӧ�����ӷ���ʽ:2Na+2H2O==2Na++2OH-+H2��
B. �ö��Ե缫�����������Һ�����ӷ���ʽ:4Ag++2H2O![]() 4Ag+O2��+4H+
4Ag+O2��+4H+
C. ��⾫��ͭ��������Ӧʽ:Cu2++2e-=Cu
D. ����ϩ�ۺϷ�Ӧ�Ļ�ѧ����ʽ: 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й�������ȷ����(����)
A. 14 g��ϩ�ͱ�ϩ��������е���ԭ����Ϊ2NA
B. 1 mol N2��4 mol H2��Ӧ���ɵ�NH3������Ϊ2NA
C. 1 mol Fe���ڹ������ᣬ����ת����Ϊ2NA
D. ��״���£�2.24 L CCl4���еĹ��ۼ���Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(NH3��BH3)��Ϊһ�ַdz���ǰ���Ĵ�����ϣ������������ܵ����ǵ����ӡ�������(NH3��BH3)��ؿ��ڳ����¹�����װ������ͼ��ʾ���õ�ص��ܷ�ӦΪ��NH3��BH3+3H2O2=NH4BO2+4H2O������˵����ȷ������ ��
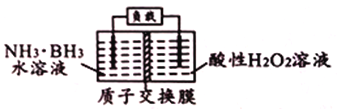
A. �Ҳ�缫����������Ӧ B. ��ع���ʱ��H+ͨ�����ӽ���Ĥ������ƶ�
C. �����ĵ缫��ӦʽΪH2O2+2H++2e-=2H2O D. ÿ����31g�����飬������Ӧת��6mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���� CO2 �� NaOH ��Һ��Ӧ���ij��Һ����ε���ϡ���ᣬ��ʼ��δ���� CO2���壬�����Һ�е�������ɿ�����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ʒӵ�һ�ֺϳ�·�����£�

������������ȷ����
A. ��NaOHˮ��Һ�м��ȣ�������X�ɷ�����ȥ��Ӧ
B. ��һ�������£�1mol������Y������4molBr2
C. ��FeCl3��Һ�ɼ�����X��Y
D. ������X��Y������̼ԭ����Ŀ��Ϊ1��2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com