
【题目】氨硼烷(NH3·BH3)作为一种非常有前景的储氢材料,近年来日益受到人们的重视。氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图所示。该电池的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )
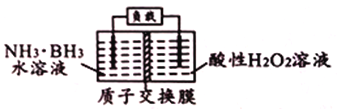
A. 右侧电极发生氧化反应 B. 电池工作时,H+通过质子交换膜向左侧移动
C. 负极的电极反应式为H2O2+2H++2e-=2H2O D. 每消耗31g氨硼烷,理论上应转移6mol电子
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】我国自主研发“对二甲苯的绿色合成路线”取得新进展,其合成示意图如下。

下列说法中,不正确的是
A. 过程i发生了加成反应
B. 对二甲苯的一溴代物只有一种
C. M所含官能团既可与H2反应,也可与Br2的CCl4溶液反应
D. 该合成路线理论上碳原子利用率为100%,且产物易分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g)在温度和容积不变的条件下进行。能说明反应达到平衡状态的叙述是( )
2HI(g)在温度和容积不变的条件下进行。能说明反应达到平衡状态的叙述是( )
A. c(H2)=c(I2) B. H2的消耗速率等于HI的分解速率
C. 容器内气体的颜色不再变化 D. 容器内压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来非常理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2+O2。制得的氢气可用于燃料电池、合成氨工业。回答下列问题:
2H2+O2。制得的氢气可用于燃料电池、合成氨工业。回答下列问题:
(1)分解海水时,________能转变为________能。生成的氢气用于燃料电池时,________能转变为________能。
(2)某种氢氧燃料电池是用NaOH溶液作电解质,正极的电极反应式为________;若把燃料改为甲烷,负极的电极反应式为________。
(3)氢气可用于合成氨。一定温度下,向2L 的密闭容器中加入1 molN2和 3molH2发生反应 N2(g)+3H2(g)![]() 2NH3(g),2min时测得N2的浓度为0.3mol/L,5min时达到平衡,此时测得压强为开始时的
2NH3(g),2min时测得N2的浓度为0.3mol/L,5min时达到平衡,此时测得压强为开始时的![]() 。则前2min用NH3表示的化学反应速率为________;平衡时,N2的转化率为________,混合气体的平均相对分子质量为________。
。则前2min用NH3表示的化学反应速率为________;平衡时,N2的转化率为________,混合气体的平均相对分子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在探究废干电池内的黑色固体回收利用时,进行了如图所示实验:

查阅教材可知,普通锌锰干电池中的黑色物质的主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作②的名称是_____。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、_____、_____和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为_____。
(3)操作④的试管中加入操作③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色滤渣中含有_____。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
实验目的 | 实验操作 | 实验现象 | 实验结论 |
①检验Cl- | 加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
②检验NH4+ | 取少许滤液于试管中, ____ | _____ | 含有NH4+ |
③检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入稀氨水,沉淀又溶解 | 含有Zn2+ |
(5)根据以上实验报告,关于滤液的成分,该同学的结论是滤液中含有NH4Cl和ZnCl2。若想从滤液中得到溶质固体,还应进行的操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是

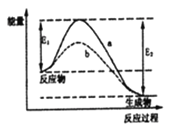
A. 使用催化剂,合成氨反应放出的热量减少
B. 在该过程中,N2、H2断键形成N原子和H原子
C. 在该过程中,N原子和H原子形成了含有非极性键的NH3
D. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+ C6![]() CoO2+ LiC6,下列说法正确的是
CoO2+ LiC6,下列说法正确的是
A. 充电时,电池的负极反应为 LiC6- e-="=" Li + C6
B. 放电时,电池的正极反应为 CoO2+ Li++ e-="=" LiCoO2
C. 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D. 锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某蛋白质的结构示意图,其中“—S—S—”为由两个“—SH”脱氢形成的二硫键,其作用是连接两个相邻肽链。若该蛋白质分子共由m个氨基酸组成,则形成一个该蛋白质分子时生成的水分子数和减少的相对分子质量分别为

A. m,18m
B. (m-4),18(m-4)
C. (m-3),18(m-3)+4
D. (m-2),18(m-2)+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大且小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的3倍,Z与Y同族,Q原子基态时3p原子轨道上有1个未成对的电子,W的原子序数为29。回答下列问题:
(1)X2Y2分子中Y原子轨道的杂化类型为____。
(2)化合物沸点比较:X2Y____X2Z,其原因是____。
(3)元素Z最高价氧化物对应水化物的阴离子空间构型为____,与该离子互为等电子体且含有Q元素的一种分子的分子式是____。
(4)W基态原子的核外电子排布式是____,元素W的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com