
����Ŀ����������AIN����ˮ��ˮ�����㷺Ӧ���ڼ��ɵ�·��������ij�о�С�����õ������������ͻ���̿��ȡ�������������ͼ1��ʾʵ��װ�á�
��ش�
��1��ͼ1���ñ���NaNO2��Һ��NH4Cl��Һ������ȡ����������ѧ����ʽΪ ��
��2��ͼ1װ�������������ܿ����ӵ�˳����(��Сд��ĸa��g��д)�� ������A�������� ��
��3������2�����Ӻ�ʵ��װ�ú����������IJ����� ��
��4������2��������ʵ��װ�ô�����ȱ���� ��
��5����Ӧ������ijͬѧ��ͼ2װ�ý���ʵ�����ⶨ ��������Ʒ������������ʵ���е���������Բ��ƣ���
���������������NaOH��Һ��Ӧ���ɰ�����ѧ��Ӧ����ʽΪ ��
�� ����ƿ�еı��������� ������ƿ�е�Һ��û��װ������ʵ����NH3������� ���ƫ����ƫС���������䡱����
����ʵ���г�ȡ��������Ʒ������Ϊ10.0 g����ð��������3. 36 L����״����������Ʒ��AlN����������Ϊ ������3λ��Ч���֣���
���𰸡���1��NaNO2+NH4Cl ![]() NaCl+2H2O+N2����
NaCl+2H2O+N2����
��2��a-e-d-g-c(��b) -g-f��
ƽ����Һ©������ƿ֮���ѹǿ��ʹNaNO2������Һ˳��������
��3�����װ�õ���������
��4��ϴ��ƿû�з�����װ�ã�û��β������װ����
��5����AlN+NaOH+H2O=NaAlO2+NH3��������ֹ��������ˮ�����䣻�� 61.5%��
��������
�����������1������ʵ��Ŀ�ĺ�ԭ�ϣ�NaNO2����������N�ɣ�3����0�ۣ����ϼ۽���3�ۣ�NH4Cl����ԭ����N�ɣ�3����0�ۣ����ϼ�����3�ۣ���С��������3����˷�Ӧ����ʽΪ��NaNO2+NH4Cl ![]() NaCl+2H2O+N2������2����ΪAlN��ˮ��ˮ�⣬��˳�ȥN2�е�ˮ��������ˣ�a��e��d��Ȼ��Ӧ��d��b��c��ͬʱҪ��ֹ������ˮ�����Ľ��룬���c��g����˲����ǣ�a-e-d-g-c(��b) -g-f������A�������ǣ�ƽ����Һ©������ƿ֮���ѹǿ��ʹNaNO2 ������Һ˳����������3����Ϊ������μӷ�Ӧ�������Ҫ��֤װ�õ������ԣ���4��ȱ�ٷ�����װ�ã���β������װ�ã�(5)����������ˮ����ˮ�ⷴӦ��AlN��3H2O=Al(OH)3����NH3�������������������ԣ���˷���Al(OH)3��NaOH=NaAlO2��2H2O���ܷ�Ӧ��AlN+NaOH+H2O=NaAlO2+NH3������NH3��������ˮ�����Ҫ��ֹ�����������������Ƿ�ֹNH3����ˮ����ʵ����Ӱ�죬���ѡ���䣻�����ݷ�Ӧ����ʽ��n(AlN)=n(NH3)=3.36/22.4mol=0.15mol������������Ϊ0.15��41/10��100%=61.5%��
NaCl+2H2O+N2������2����ΪAlN��ˮ��ˮ�⣬��˳�ȥN2�е�ˮ��������ˣ�a��e��d��Ȼ��Ӧ��d��b��c��ͬʱҪ��ֹ������ˮ�����Ľ��룬���c��g����˲����ǣ�a-e-d-g-c(��b) -g-f������A�������ǣ�ƽ����Һ©������ƿ֮���ѹǿ��ʹNaNO2 ������Һ˳����������3����Ϊ������μӷ�Ӧ�������Ҫ��֤װ�õ������ԣ���4��ȱ�ٷ�����װ�ã���β������װ�ã�(5)����������ˮ����ˮ�ⷴӦ��AlN��3H2O=Al(OH)3����NH3�������������������ԣ���˷���Al(OH)3��NaOH=NaAlO2��2H2O���ܷ�Ӧ��AlN+NaOH+H2O=NaAlO2+NH3������NH3��������ˮ�����Ҫ��ֹ�����������������Ƿ�ֹNH3����ˮ����ʵ����Ӱ�죬���ѡ���䣻�����ݷ�Ӧ����ʽ��n(AlN)=n(NH3)=3.36/22.4mol=0.15mol������������Ϊ0.15��41/10��100%=61.5%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ������ͼ��ʾ������T������������������������ȡ������жϲ���ȷ���� �� ��
![]()
A. �����̬�⻯������ȶ��ԣ�R>Q
B. ����������Ӧˮ��������ԣ�Q<W
C. ԭ�Ӱ뾶��T>Q>R
D. ��T������Һһ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���л��ﱻ��ԭ����( )
A����ȩ����������Ӧ
B������Cu(OH)2����ȩ��Ӧ
C����ȩ�������Ҵ�
D����ȩ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѣ����ǡ��ڵ��ۡ��۵����ʡ�����֬��ϡ����ڵ������·ֱ����ˮ�⣬���ֻ�õ�һ�ֲ������
A���ٺ͢� B���� C���ڢۺ͢� D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ�ݻ�Ϊ5 L�����������ܱ������ڣ����� 0.3 mol��CO��0.3 mol��H2O���ڴ������ں�800���������¼��ȣ��������·�Ӧ��CO��g����H2O��g�� ![]() CO2��g����H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�����ͼ��
CO2��g����H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�����ͼ��
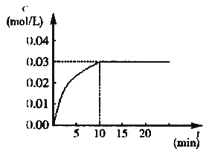
��1������ͼ�����ݣ���Ӧ��ʼ���ﵽƽ��ʱ��CO�Ļ�ѧ��Ӧ����Ϊv��CO���� mol/��L��min�������¶���800�����µ�ƽ�ⳣ��K�� ��
��2�����������������£��ı������������´ﵽƽ��ʱ��ʹƽ�ⳣ��K������� ������ĸ��
A�������¶�
B�������¶�
C������ѹǿ
D����Сѹǿ
E���������
G���Ƴ�һ����̼����
��3����Ҫһ��ʼ����0.1 mol��CO��0.1 mol��H2O��0.2 mol��CO2��0.2 mol��H2������ͬ�������£���Ӧ��ƽ��ʱ��c��CO����___________mol/L��
��4���������¶Ⱥ�������������䣬����1��������ƽ����ϵ�У��ٳ���0.3mol ��ˮ���������´ﵽƽ���H2O��ת����_____________������ߡ��������͡����ǡ����䡱����
��5���ڴ������ں�800���������£���ijһʱ�̲��c��CO����c��H2O����0.09mol/L,c��CO2 ����c��H2����0.13mol/L,��˷�Ӧ�Ƿ���ƽ��״̬: �������ǡ�����,��û�д���ƽ��״̬��÷�Ӧ�� �����ƶ����������Ӧ�����淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�ӣ�����ĸ��ʾ��������������ԭ�������Ĺ�ϵͼ��˵����ȷ���ǣ� ��

A. X��W�γɵĻ�������ֻ�й��ۼ�
B. X��Z�γɵĻ�������ֻ�����Ӽ�
C. Ԫ�صķǽ����ԣ� X��R��W
D. �����ӵİ뾶��W��R��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������к���Ӧ����Ŀ������
A��0��4molNaCl����������
B����״����5��6L CO2����ԭ����
C��1L1 mol��L��1��������HCl������
D��10g��������ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10g Na2O2��Na2O��Na2CO3��NaOH�Ļ������100g��������Ϊ3.65%������ǡ�÷�Ӧ��������Һ�����յù�������Ϊ�� ��
A��11.7g B��5.85g C��8g D��15.5g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.0 mL 0.10 mol/L��ˮ�е���0.10 mol/L�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ�������������ݳ����������й�������ȷ���ǣ� ��

A��M��N��һ�����ڣ�c(Cl��)>c(NH4+)>c(OH��)>c(H+)
B��M���Ӧ���������Ϊ10.0mL
C��pH=7����Һ�У�c(NH4+)=c(Cl��)=c(H+)=c(OH��)
D��P�㴦����Һ�д��ڣ�2c(NH4+)+2c(NH3��H2O)=c(Cl��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com