
氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,
减少N 的氧化物在大气中的排放是环境保护的重要内容之一。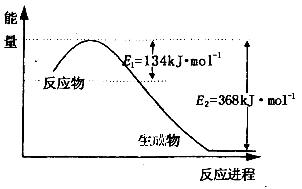
(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,则反应2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g) 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |

(1)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol(2分);-760.3 kJ/mol(2分)
(2)①K= (2分);放(1分) ②49.6%(2分);不变(1分)
(2分);放(1分) ②49.6%(2分);不变(1分)
③c(2分);1.51×10-3mol/(L·s)-1(2分)
解析试题分析: (1)根据图像可知,1molNO2和1mol CO所具有的总能量高于1molCO2和1molNO所具有的总能量,因此该反应是放热反应,反应热△H=134 kJ/mol-368kJ/mol=-234kJ/mol,所以该反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol。已知①N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol;③NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol,则根据盖斯定律可知,②-①+③×2即得到反应2NO(g)+2CO(g) N2(g)+ 2CO2(g),所以该反应的反应热△H=-112.3kJ/mol-180kJ/mol-234kJ/mol×2=-760.3 kJ/mol。
N2(g)+ 2CO2(g),所以该反应的反应热△H=-112.3kJ/mol-180kJ/mol-234kJ/mol×2=-760.3 kJ/mol。
(2)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数K= 。己知:K300℃>K350℃,这说明升高温度平衡向逆反应方向移动,平衡常数减小,所以该反应是放热反应。
。己知:K300℃>K350℃,这说明升高温度平衡向逆反应方向移动,平衡常数减小,所以该反应是放热反应。
②根据表中数据可知,反应进行到1000s时,NO2的物质的量不再发生变化。此时NO2的物质的量是10.08mol,则反应中消耗NO2的物质的量是20mol-10.08mol=9.92mol,反应达到平衡后,NO2的转化率为 ×100%=49.6%。平衡时若再通入一定量氮气,压强增大,但由于物质的浓度不变,因此平衡不移动,则NO2的转化率不变。
×100%=49.6%。平衡时若再通入一定量氮气,压强增大,但由于物质的浓度不变,因此平衡不移动,则NO2的转化率不变。
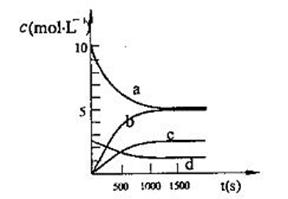
③N2O5是生成物,根据方程式可知,平衡时生成N2O5的物质的量是9.92mol÷2=4.96mol,其浓度是4.96mol÷2L=2.48mol/L,所以符合条件的曲线是c;根据表中数据可知,反应进行到500s时消耗NO2的物质的量是20mol-13.96mol=6.04mol,则根据方程式可知,消耗氧气的物质的量是6.04mol÷4=1.51mol,其浓度是1.51mol÷2L=0.755mol/L,所以用O2表示从0~500 s内该反应的平均速率v=0.755mol/L÷500s=1.51×10-3mol/(L·s)-1。
考点:考查反应热计算与热化学方程式书写、平衡常数、外界条件对平衡状态的影响、反应速率的计算以及图像分析与应用


科目:高中化学 来源: 题型:填空题
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下: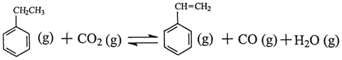 △H
△H
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行: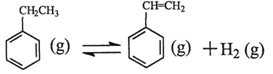 △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反应的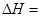 。
。
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a.正、逆反应速率的比值恒定 b.c(CO2)=c(CO)
c.混合气体的密度不变 d.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填正确答案编号)
| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含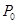 、P的表达式表示)。
、P的表达式表示)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。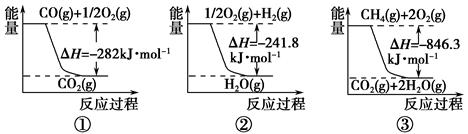
反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)上图是1 mol NO2气体和1 mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
已知:N2 (g)+2NO2 (g)  4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1,
则反应: 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H= ;
N2(g)+2CO2(g) 的△H= ;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20 mol NO2和5 mol O2发生反应: 4NO2(g)+O2(g) 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)工业上制备BaCl2的工艺流程图如图: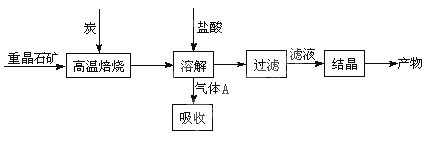
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s)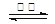 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)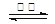 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
| A.Na2S溶液的pH比NaHS溶液pH小 |
| B.两溶液中含有的离子种类不同 |
| C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等 |
| D.两溶液中加入NaOH固体,c(S2-)都增大 |
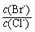 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】 2CO(g)的ΔH =
2CO(g)的ΔH = 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知:C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
H2O(1) ===H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式 。
(2)在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体。请回答下列问题:
① 写出D电极反应式: ;
②写出水槽中电解AgNO3溶液总反应的离子方程式: ,阴极增重2.16 g,则阳极上放出的气体在标准状况下的体积是____ _L。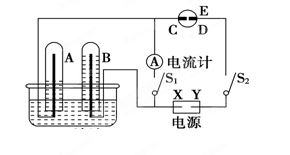
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下: 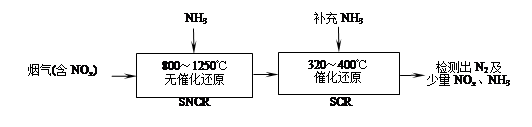
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
①4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
②6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
③6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。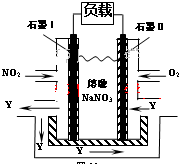
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-。
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式: 。
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com