
【题目】下列实验操作或事故处理方法正确的是( )
A. 金属钠着火,立即用水扑灭
B. 实验结束后,用嘴吹熄酒精灯
C. 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
D. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 向NaHCO3溶液中滴加澄清石灰水,不会产生沉淀
B. 等质量NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2在同温同压下体积相同
C. 向Na2CO3溶液中缓慢通入等物质的量的HCl,生成的CO2与原Na2CO3的物质的量之比为1:2
D. 向Na2CO3饱和溶液中通入CO2,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:

(1)工业上天青石焙烧前先研磨粉碎,其目的是_______________________________。
(2)工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:__________________________。
(3)加入硫酸的目的是____________________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L[注:此时滤液中Ba2+浓度为1×105 mol/L,Ksp(BaSO4)=1.1×1010,Ksp(SrSO4)=3.3×107]。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl外,不含其它与Ag+反应的离子),待Cl完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)己经被广泛应用在水处理方面,高铁酸钾的氧化性很强,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的化学过程正确的有( )
①蛋白质的变性②蛋白质的盐析③胶体聚沉④盐类水解⑤焰色反应⑥氧化还原反应
A. ①②③④ B. ①③④⑥ C. ②③④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用或操作正确的是( )
A. 烧杯、烧瓶、锥形瓶均可加垫石棉网加热
B. 试剂瓶可以用于存放、溶解、稀释药品
C. 用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至刻度线
D. 用滴定管量取液体时,开始读数和最后读数均俯视,则量取的体积准确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2通入碘水中,分别进行下列实验,能证明SO2与碘发生氧化还原反应的是
操作 | 现象或结果 | |
A | 取混合溶液加入淀粉溶液 | 溶液变蓝 |
B | 取混合溶液加入BaCl2溶液 | 有白色沉淀 |
C | 测通入前后溶液的pH | pH减小 |
D | 取混合溶液加入AgNO3溶液 | 有黄色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017·北京]TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol1
2C(s)+O2(g)=2CO(g) ΔH2=220.9 kJ·mol1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。

③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
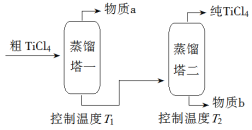
物质a是______________,T2应控制在_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是_________________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有____________气体产生,写出D中发生反应的离子方程式______________________。若去掉C,能否得出同样结论____________(填“是”或“否”) ,原因是____________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
___________________________ | ________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为________________________。
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com