
2008年奥运会金牌背面镶嵌着白玉,白玉的化学式可用CaxMgySipO22(0H)2表示(也可用Ca、Mg、Si、H的氧化物表示).
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为 g/mol.
(2)另取4.05g白玉粉末加入1mol/L的盐酸1OOmL中充分溶解,得不溶物2.40g.过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP).则
①p= ;②白玉的化学式为 .
| 含硅矿物及材料的应用.. | |
| 专题: | 碳族元素. |
| 分析: | (1)灼烧白玉粉末质量减少的是水,根据白玉与水的关系式计算其摩尔质量; (2)①不溶物是二氧化硅,根据白玉与二氧化硅的关系式计算P值; ②最后的溶液含有CaCl2、MgCl2、FeCl2,根据Ca、Mg 原子守恒分别用x、y表示出CaCl2、MgCl2的物质的量,根据H2的体积求出FeCl2的物质的量,利用Cl原子守恒,列出方程;再利用白玉的相对原子质量列出另一方程,联立方程求解,确定白玉的化学式. |
| 解答: | 解:(1)白玉粉末灼烧后,质量减少的是水,根据氢原子守恒得白玉和水的关系式,设白玉的摩尔质量为M. CaxMgySipO22(0H)2﹣﹣H2O 1mol 1mol
所以M=810g/mol 故答案为:810. (2)①通过题意知,酸过量,所以不溶物是二氧化硅,根据硅原子守恒得白玉与二氧化硅的关系式, CaxMgySipO22(0H)2﹣﹣PSiO2, 1mol pmol
1mol:pmol= 解得p=8 故答案为:8 ②4.05g白玉的物质的量为n= 由 FeCl2~H2关系式,得n( FeCl2)=n(H2)= 由Cl原子守恒,列方程:2×0.005xmol+2×0.005ymol+2×0.015mol=0.1L×lmol/L; 由白玉的相对原子质量为810,列方程:40x+24y+28×8+16×22+17×2=810; 联立方程,解得:x=2;y=5 白玉的化学式为:Ca2Mg2Si8O22(0H)2 故答案为:Ca2Mg2Si8O22(0H)2 |
| 点评: | 以硅酸盐为载体考查化学计算,理清反应过程是本题的关键,利用守恒、关系式简化计算,在学习中要多加注意. |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成a mol NH3,这时N2的物质的量为 mol;
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为 mol和 mol;
(3)若开始时放入x mol N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= ,y= ,平衡时H2的物质的量_____(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是 ;
(4)若在(3)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设计一个简单并能一次性完成的实验,验证醋酸、碳酸、苯酚的酸性强弱顺序是:CH3COOH>H2CO3>C6H5 OH
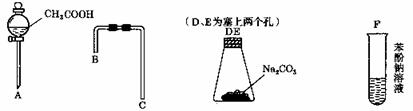
(1)仪器A的名称是 。
(2)利用上图所示的仪器可以组装实验装置,则仪器的连接顺序为: 接 ,
接 , 接 。
(3)有关反应的化学方程式为
。
(4)苯酚俗称 ,具有一定的杀菌能力,可以用作杀菌消毒剂,长期露置在空气中其表面会变为 色。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大.Z和N可以形成ZN2型化合物.下列有关说法正确的是( )
|
| A. | X与Y只能形成一种化合物 |
|
| B. | 最高价氧化物对应水化物的碱性:Y>Z |
|
| C. | 气态氢化物的热稳定性:M>N |
|
| D. | 单质的氧化性:X<M |
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2CO3俗名纯碱,下面是对纯碱采用不同分类法进行分类,其中不正确的是( )
A.Na2CO3是碱 B.Na2CO3是盐
C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列判断正确的是 ( )
A.18gH2O含有的氢原子数目为NA
B.标准状况下,22.4LH2O含有的分子数目为NA
C.24g Mg变为Mg2+时失去的电子数为NA
D.常温常压下,71gCl2中含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于强弱电解质的叙述错误的是 ( )
A.弱电解质在溶液中部分电离,存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
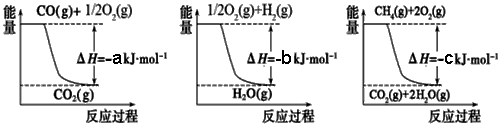
 ① 用焦炭跟水反应:C(s) + H2O(g)
① 用焦炭跟水反应:C(s) + H2O(g)  CO(g) + H2(g);
CO(g) + H2(g);
② 用天然气跟水蒸气反应:CH4(g) + H2O(g)  CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
已知有关反应的能量变化如下图,且方法②的反应只能在高温下发生,
则方法②中反应的ΔH =___________ kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g) + N2(g)  2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 |
(1) 下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2) 甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3) 乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4) 分析上表数据,下列关系正确的是________.
a.2c1 = 3mol/L b.ω1 = ω2 c. 2ρ1 = ρ2
(5) 该温度下,容器乙中,该反应的平衡常数K=__________(用分数表示)(mol/L)-2。
(6) 常温下NH4+(aq) + H2O(l) 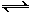 NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
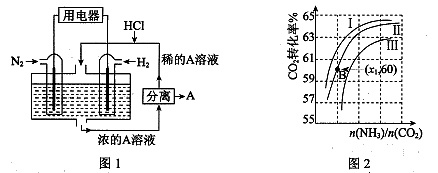
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示。
电池正极的电极反应式是 ,A是 。
(2)用氨合成尿素的反应为2NH3(g) + CO2(g) 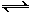 CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比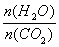 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com