
���ĺϳ�������Ҫ�Ļ�������֮һ��
��ҵ�Ϻϳɰ��õ�H2�ж�����ȡ�ķ�����
 �� �ý�̿��ˮ��Ӧ��C(s) + H2O(g)
�� �ý�̿��ˮ��Ӧ��C(s) + H2O(g)  CO(g) + H2(g)��
CO(g) + H2(g)��
�� ����Ȼ����ˮ������Ӧ��CH4(g) + H2O(g)  CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
��֪�йط�Ӧ�������仯����ͼ���ҷ����ڵķ�Ӧֻ���ڸ����·�����
�����з�Ӧ�Ħ�H =___________ kJ/moL��
����3��1L���ܱ������У�ͬ�¶��¡�ʹ����ͬ�����ֱ���з�Ӧ��
3H2(g) + N2(g)  2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���Ӧ�ﵽƽ��ʱ�й�����Ϊ��
2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���Ӧ�ﵽƽ��ʱ�й�����Ϊ��
| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 3 mol H2��2 mol N2 | 6 mol H2��4mol N2 | 2 mol NH3 |
| �ﵽƽ���ʱ�䣨min�� | t | 5 | 8 |
| ƽ��ʱN2��Ũ�ȣ�mol��L-1�� | c1 | 3 | |
| N2��������� | ��1 | ��2 | ��3 |
| ��������ܶȣ�g��L-1�� | ��1 | ��2 |
(1) ������˵���÷�Ӧ�Ѵﵽƽ��״̬����
a��������N2��H2��NH3��Ũ��֮��Ϊ1�U3�U2 b��v(N2)����3v(H2)��
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
(2) �������дﵽƽ������Ҫ��ʱ��t 5min (��>��< ��=)
(3) ���дӷ�Ӧ��ʼ��ƽ��ʱN2��ƽ����Ӧ���� (ע����λ)��
(4) �����ϱ����ݣ����й�ϵ��ȷ����________.
a��2c1 = 3mol/L b����1 = ��2 c�� 2��1 = ��2
(5) ���¶��£��������У��÷�Ӧ��ƽ�ⳣ��K=__________���÷�����ʾ��(mol/L)��2��
(6) ������NH4��(aq) + H2O(l)  NH3•H2O(aq) + H��(aq)�Ļ�ѧƽ�ⳣ��Ϊ5.55��10��10 mol��L��1����NH3•H2O�ĵ���ƽ�ⳣ��K= (������λ��Ч����)����֪����ĵ��볣��Ϊ��Ka1=5.9��10��2 Ka2=6.4��10��5���������淋�ˮ��Һ������Ũ���ɴ�С��˳���ǣ�________________________________________��
NH3•H2O(aq) + H��(aq)�Ļ�ѧƽ�ⳣ��Ϊ5.55��10��10 mol��L��1����NH3•H2O�ĵ���ƽ�ⳣ��K= (������λ��Ч����)����֪����ĵ��볣��Ϊ��Ka1=5.9��10��2 Ka2=6.4��10��5���������淋�ˮ��Һ������Ũ���ɴ�С��˳���ǣ�________________________________________��
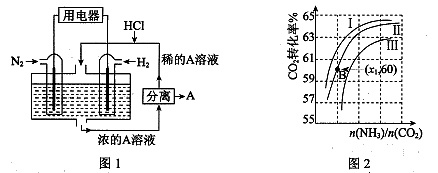
��(1)����������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ����ͼ1��ʾ��
��������ĵ缫��Ӧʽ�� ��A�� ��
(2)�ð��ϳ����صķ�ӦΪ2NH3(g) + CO2(g) 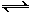 CO(NH2)2(s)+ H2O(g)����ҵ����ʱ��ԭ��������ˮ������ͼ2��ʾCO2��ת�����백̼��
CO(NH2)2(s)+ H2O(g)����ҵ����ʱ��ԭ��������ˮ������ͼ2��ʾCO2��ת�����백̼�� ��ˮ̼��
��ˮ̼��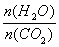 �ı仯��ϵ��
�ı仯��ϵ��
�����ߢ��Ӧ��ˮ̼�������� ��
�ڲ��B�㰱��ת����Ϊ40%����x1 ��
��֪ʶ�㡿��Ӧ�Ⱥ��ʱ䡢��Ӧ���ʡ���ѧƽ�ⳣ���ĺ��塢��ѧƽ��״̬���ж�
���𰸽����� ��H =+(a+3b��c) (2��)
��(1) c (1��) (2) t > 5 (1��) (3) 0.2 mol��L��1��min��1(1�֣���λ0��)
(4) c (1��) (5) K= 4/81(2��) (6) 1.80��10��5mol��L-1(1�֣���λ0��)
C(NH4+)��C(HC2O4��)��C(H+)��C(C2O42��)��C(OH��) (2��)
��(1) N2 + 6e�� + 8H+ �� 2NH4+ (1��)��NH4Cl (1��) (2) ��(1��)��3 (1��)
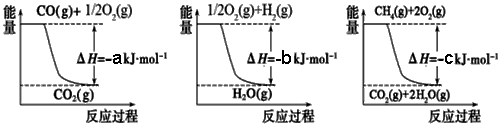
����������ͼ1��ͼ2��ͼ3д���Ȼ�ѧ����ʽ�ֱ�Ϊ��
��CO��g��+1/2 O2��g���TCO2��g����H=-akJ•mol-1
��H2��g��+1/2 O2��g���TH2O��g����H=-bkJ•mol-1
��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H=-ckJ•mol-1��
�ɢ�-����+�ڡ�3���ã�CH4��g��+H2O��g���TCO��g��+3H2��g����H=+��a+3b-c��kJ•mol-1��
��1��a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2������˵���ﵽ�ж�״̬��ȡ������ʼ���ϱȺ�ת���̶ȣ���a����
b����3v��N2����=v��H2����ʱ����˵���ﵽƽ��״̬����b����
c��������ѹǿ���ֲ��䣬��˵���ﵽƽ��״̬����c��ȷ��
d������ʱ������䣬�������䣬����������ܶȱ��ֲ��䣬���ܴﵽƽ��״̬����d����
�ʴ�Ϊ��c��
��2����Ϊ��ѹ���������������дﵽƽ������ʱ����ͬ��Ϊ5min�������������ݣ����������������з�Ӧ���Ũ��С����Ӧ���ʱ�����С���ʴﵽƽ������Ҫ��ʱ���������t��5min���ʴ�Ϊ������
��3���������У���Ӧǰ������Ũ��Ϊ��4mol��1L=4mol/L��������ƽ����Ӧ����Ϊ��v��N2��=(4-3)mol/L��5min=0.2mol•L-1•min-1��
��4�����¡����������£�
a���������������ݻ�Ϊ2L����ﵽƽ��ʱ����Ϊ��Чƽ�⣬����ֵĺ�����Ũ����ȣ���ʱ������Ũ��Ϊc1��Ȼ���������ݻ���С��2L����ƽ�ⲻ�ƶ���2c1=3mol/L������ѹǿ����ƽ�����������ƶ�������2c1��3mol/L����a����
b�����м�����4mol������6mol������������Ϊ3mol H2��2mol N2�����ҶԼ���˵�൱�ڼ�ѹ��ƽ�����ƣ����������������С�����Ԧ�2����1����b����
c����Ӧǰ�������壬�������ݻ�����2L�����л�����������Ϊ��2�������ݦ�=m/V
��֪��2��1=��2����c��ȷ��
��5���������У���Ӧǰ����Ũ��Ϊ��c��H2��=6mol��1L=6mol/L��������Ũ��Ϊ��4mol��1L=4mol/L���ﵽƽ��ʱ������Ũ�ȱ仯Ϊ����4-3��=1mol/L��
������ʽ��֪��3H2 ��g��+N2��g��⇌2NH3��g��
��Ӧǰ��mol/L���� 6 4 0
Ũ�ȱ仯��mol/L����3 1 2
��Ӧ��mol/L����3 3 2
�ڸ��¶����������з�Ӧ��ƽ�ⳣ��K=22/(33��3)=4/81��
��6��NH4��(aq) + H2O(l) 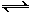 NH3•H2O(aq) + H��(aq)�Ļ�ѧƽ�ⳣ��Ϊ
NH3•H2O(aq) + H��(aq)�Ļ�ѧƽ�ⳣ��Ϊ
C(NH3•H2O)��C(H��)/C(NH4��)=5.55��10��10 mol��L��1��NH3•H2O�ĵ���ƽ�ⳣ��
K= C(NH4��)��C(OH-)/C(NH3•H2O)=Kw/5.55��10��10=1.80��10��5mol��L-1������֪֪笠���ˮ�ⳣ��Ϊ5.55��10��10��������Ķ������볣��Ka2=6.4��10��5��ˮ��С�ڵ��룬��Һ�����ԡ�������Һ��C(NH4+)��C(HC2O4��)��C(H+)��C(C2O42��)��C(OH��)
��(1)�������������ԭ��Ӧ�������õ��ӷ�����ԭ��Ӧ��N2+8H++6e-=2NH4+��A��笠������������ӽ���γ��Ȼ�泥�
��2���ٰ�̼����ͬʱ���ߢ������̼��ת���ʴ�����������ѡ��ˮ̼�ȵ���ֵΪ�ʴ�Ϊ����
���������֪��2NH3��g��+CO2��g��⇌CO��NH2��2+H2O��g��
��ʼ�� x1 1
�仯�� 2a a
����2a/x1��40%�� a/1��60%����x1=3��
��˼·�㲦�����⿼���⿼���Ϊ�ۺϣ��漰��ѧ��Ӧ����������ѧƽ���Ӱ�����ء���ѧƽ�⡢���ʵļ���ȣ�������ѧ���ķ��������ͼ��������Ŀ��飬Ϊ�߿��������ͺ�Ƶ���㣬ע����������ʽ�����㣬��Ϊֱ�ۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2008����˻���Ʊ�����Ƕ�Ű�����Ļ�ѧʽ����CaxMgySipO22��0H��2��ʾ��Ҳ����Ca��Mg��Si��H���������ʾ����
��1��ȡ8.10g�����ĩ���������أ����������0.18g��������Ħ������Ϊ����g/mol��
��2����ȡ4.05g�����ĩ����1mol/L������1OOmL�г���ܽ⣬�ò�����2.40g�����ˣ�����Һ��ϴ��Һ�ϲ��������м�����������м���õ�����336mL��STP������
��p=�������ڰ���Ļ�ѧʽΪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��T��ʱ����a g NH3��ȫ����ˮ���õ�V mL��Һ���������Һ���ܶ�Ϊ�� g/cm3�����ʵ���������Ϊ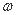 �����ʵ���Ũ��Ϊc mol��L-1��������ѡ���ȷ����
�����ʵ���Ũ��Ϊc mol��L-1��������ѡ���ȷ����
A�����ʵ���������Ϊ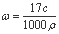
B����ˮϡ����Һ��OH- �����ʵ�������
C������Һ�й���6����
D��������Һ���ټ���V mLˮ��������Һ���ʵ�������������0.5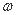
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij���������л������ֻ��̼���⡢������Ԫ�أ���Է�������Ϊ58����ȫȼ��ʱ���������ʵ�����CO2��H2O�������ܵĽṹ���У������������칹��
A��4�� B��5�� C��6�� D��7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ������������ȷ����
A��0.1mol��L��1��Na2CO3��Һ�У������ӵ�����Ŀ����0.1NA
B�������£�46 g NO2��N2O4��������к��еķ�������Ϊ2NA
C����״���£�22.4L��HF����NA������
D����״���£�10g�ĸ�������к���2.2NA�����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�������ʵ����Ʒֱ���
| ���� | ��������� | ���� | �������� | �������� |
| ��ѧʽ | Na2S2O3 | CaSx | BaO2 | KO2 |
���������������ɻش�K2CS3Ӧ����Ϊ
A�������̼��� B������̼��� C������̼��� D������̼���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һԪ���һԪ��������Һ���� pH�ֱ�Ϊ2��12������Һ�������Ϻ��pHΪ
A��һ������7 B��һ��С��7
C��һ������7 D�����ڣ�С�ڣ������7���п���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ���ݻ��� ��Ϊ2 L���ܱ������У�������ӦaA(g)��bB(g)
��Ϊ2 L���ܱ������У�������ӦaA(g)��bB(g) pC(g)����H��������Ӧ�����¼�����
pC(g)����H��������Ӧ�����¼�����
| ʱ�� | c(A) (mol��L��1) | c(B) (mol��L��1) | c(C) (mol��L��1) |
| 0 | 1 | 3 | 0 |
| ��2 min[ | 0.8 | 2.6 | 0.4 |
| ��4 min | 0.4 | 1.8 | 1.2 |
| ��6 min | 0.4 | 1.8 | 1.2 |
����ϸ���������ݱ������ݣ��ش��������⣺
(1)a��________��b��________��p��________��(ȡ��С������)
(2)��2 min����4 min��A��ƽ����Ӧ����v(A)��________ mol��L��1��min��1��
(3)���ӿ�ʼ����4 min����ƽ��ʱ��Ӧ�ų�������Ϊ235.92 kJ����÷�Ӧ�Ħ�H��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com