
有一元酸和一元碱两种溶液,其 pH分别为2和12,两溶液等体积混合后的pH为
A.一定大于7 B.一定小于7
C.一定等于7 D.大于.小于.或等于7都有可能
科目:高中化学 来源: 题型:
下列关于强弱电解质的叙述错误的是 ( )
A.弱电解质在溶液中部分电离,存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
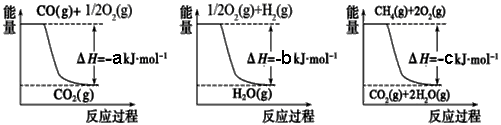
 ① 用焦炭跟水反应:C(s) + H2O(g)
① 用焦炭跟水反应:C(s) + H2O(g)  CO(g) + H2(g);
CO(g) + H2(g);
② 用天然气跟水蒸气反应:CH4(g) + H2O(g)  CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
已知有关反应的能量变化如下图,且方法②的反应只能在高温下发生,
则方法②中反应的ΔH =___________ kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g) + N2(g)  2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 |
(1) 下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2) 甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3) 乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4) 分析上表数据,下列关系正确的是________.
a.2c1 = 3mol/L b.ω1 = ω2 c. 2ρ1 = ρ2
(5) 该温度下,容器乙中,该反应的平衡常数K=__________(用分数表示)(mol/L)-2。
(6) 常温下NH4+(aq) + H2O(l)  NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示。
电池正极的电极反应式是 ,A是 。
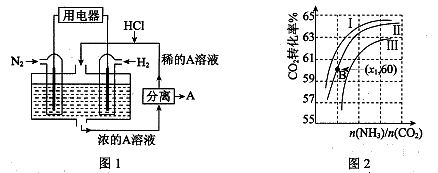
(2)用氨合成尿素的反应为2NH3(g) + CO2(g) 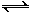 CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比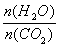 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:
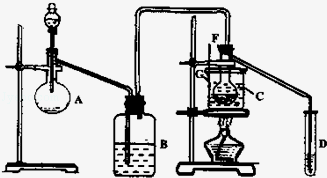
某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右)。但HgSO4遇到某些特定物质常会发 生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
(1)实验开始时,仪器A中盛放电石,B中应装入_______,其作用是_________ 。
(2)仪器D中盛放水,其作用是__________________________________________ 。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称_______________________ 。
(4)所选用温度计G的量程表示正确的是________ 。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.50℃~100℃
(5)检验乙醛已制出的操作、现象是______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的2.24L CO2通入150mL1mol/LNaOH溶液中,下列说法正确的是
A.c(HCO3-)略大于c(CO32-) B.c(HCO3-)等于c(CO32-)
C.c(Na+)等于c(CO32-)与c(HCO3-)之和 D.c(HCO3-)略小于c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量 浓度关系正确的是
浓度关系正确的是
A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO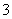 )>c(CO
)>c(CO )>c(H2CO3)
)>c(H2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO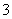 )+c(H2CO3)
)+c(H2CO3)
C. 向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO )>c(HCO
)>c(HCO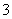 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1:
c(Na+)=0.1 mol·L-1:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是

A.图甲中t2时刻发生改变的条件是增大反应物的浓度
B.图甲中t2时刻发生改变的条件可能是增大压强
C.图乙中t2时刻发生改变的条件是升高温度
D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com