
下列有关电解质溶液中微粒的物质的量 浓度关系正确的是
浓度关系正确的是
A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO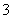 )>c(CO
)>c(CO )>c(H2CO3)
)>c(H2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO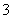 )+c(H2CO3)
)+c(H2CO3)
C. 向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO )>c(HCO
)>c(HCO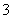 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1:
c(Na+)=0.1 mol·L-1:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
已知下列物质的名称分别是
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
根据上述命名规律回答:K2CS3应命名为
A.三硫代碳酸钾 B.多硫碳酸钾 C.过硫碳酸钾 D.超硫碳酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
有一元酸和一元碱两种溶液,其 pH分别为2和12,两溶液等体积混合后的pH为
A.一定大于7 B.一定小于7
C.一定等于7 D.大于.小于.或等于7都有可能
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,浓度均为0.1 mol/L的6种溶液pH如下:
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
请由上表数据回答:
(1)常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是(填序号) 。
a.H2SiO3 b.H2SO3 c.H2CO3
(2)用离子方程式说明Na2CO3溶液pH>7的原因 。
(3)6种溶液中,水的电离程度最小的是(填化学式) 。
(4)若增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是(填化学式) ,
用化学平衡移动的原理解释其原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2和K1的单位均为mol·L-1 B.K2>K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积固 定为2 L的密闭容器中,发生反应aA(g)+bB(g)
定为2 L的密闭容器中,发生反应aA(g)+bB(g) pC(g) ΔH=?,反应情况记录如表:
pC(g) ΔH=?,反应情况记录如表:
| 时间 | c(A) (mol·L-1) | c(B) (mol·L-1) | c(C) (mol·L-1) |
| 0 | 1 | 3 | 0 |
| 第2 min[ | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
请仔细分析,根据表中数据,回答下列问题:
(1)a=________,b=________,p=________。(取最小正整数)
(2)第2 min到第4 min内A的平均反应速率v(A)=________ mol·L-1·min-1。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(两侧温度、压强均相同)。则混合气体中CO和CO2的分子个数比为 ( )
A.1:1 B.1:3 C.3:1 D.2:1

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com