
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2和K1的单位均为mol·L-1 B.K2>K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能够完成相应实验的一项是
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 三脚架、泥三角、坩埚、坩埚钳 | 煅烧石灰石制取生石灰 |
| B | 烧杯、玻璃棒、胶头滴管、100 mL容量瓶 | 用浓盐酸配制100mL 0.1 mol·L-1的稀盐酸溶液 |
| C | 烧杯、玻璃棒、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
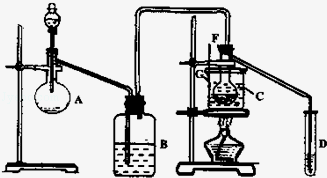
某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右)。但HgSO4遇到某些特定物质常会发 生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
(1)实验开始时,仪器A中盛放电石,B中应装入_______,其作用是_________ 。
(2)仪器D中盛放水,其作用是__________________________________________ 。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称_______________________ 。
(4)所选用温度计G的量程表示正确的是________ 。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.50℃~100℃
(5)检验乙醛已制出的操作、现象是______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量 浓度关系正确的是
浓度关系正确的是
A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO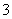 )>c(CO
)>c(CO )>c(H2CO3)
)>c(H2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO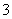 )+c(H2CO3)
)+c(H2CO3)
C. 向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO )>c(HCO
)>c(HCO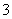 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1:
c(Na+)=0.1 mol·L-1:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
图中曲线1表示_______的分布系数变化;曲线2表示________的分布系数变化。 现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4 ③H2C2O4 ④(NH4)2C2O4 ⑤NH4HC2O4 已知NaHC2O4溶液显酸性。
(1) Na2C2O4溶液中,c(Na+)/ c(C2O42-) 2 (填“>”、“=”、“<”),原因是
Na2C2O4溶液中,c(Na+)/ c(C2O42-) 2 (填“>”、“=”、“<”),原因是
(用离子方程式表示)。
(2)常温下,向10 mL 0. 1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显_____性(填“酸”、“碱”或“中”),且V(NaOH)______10 mL(填“>”、“=”或“<”)。
(3)下列关于五种溶液的说法中,正确的是( )
A.溶液②中,c(C2O42-) < c(H2C2O4)
B.溶液②中,c(H2C2O4)+ c(OH-) = c(C2O42-)+ c(H+)
C.溶液④⑤中都符合c(NH4+)+ c(H+)= c(HC2O4-)+2 c(C2O42-)+ c(OH-)
D.五种溶液都符合c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)= 0.1 mol·L-1 .
(4)五种溶液中c(H2C2O4)由大到小排列的顺序是____________________。
 (5)配平氧化还原反应方程式:
(5)配平氧化还原反应方程式:
称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20 mL时,溶液由无色变为浅 红色。第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16 mL时恰好反应完全。则原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________。
红色。第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16 mL时恰好反应完全。则原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是

A.图甲中t2时刻发生改变的条件是增大反应物的浓度
B.图甲中t2时刻发生改变的条件可能是增大压强
C.图乙中t2时刻发生改变的条件是升高温度
D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g
2NH3(g ) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是
) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是

A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现“绿色化学实验”进课堂,某化学教师将钠与氯气反应的装置作如下改进:将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。
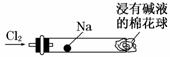
以下叙述中,错误的是
A.白烟中的固体小颗粒是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免污染空气
C.钠在氯气中着火燃烧产生苍白色火焰
D.发生的反应为2Na+Cl2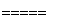 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.天然油脂的分子中含有酯基,属于酯类
B.苯的分子式为C6H6,分子中的碳原子远远没有饱和,因此能和氯水发生加成反应
C.所有卤代烃都难溶于水,且都是密度比水大的液体
D.天然气与液化石油气的成分相同,与水煤气的成分不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com