
在一个容积固 定为2 L的密闭容器中,发生反应aA(g)+bB(g)
定为2 L的密闭容器中,发生反应aA(g)+bB(g) pC(g) ΔH=?,反应情况记录如表:
pC(g) ΔH=?,反应情况记录如表:
| 时间 | c(A) (mol·L-1) | c(B) (mol·L-1) | c(C) (mol·L-1) |
| 0 | 1 | 3 | 0 |
| 第2 min[ | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
请仔细分析,根据表中数据,回答下列问题:
(1)a=________,b=________,p=________。(取最小正整数)
(2)第2 min到第4 min内A的平均反应速率v(A)=________ mol·L-1·min-1。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=________。
科目:高中化学 来源: 题型:
氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
 ① 用焦炭跟水反应:C(s) + H2O(g)
① 用焦炭跟水反应:C(s) + H2O(g)  CO(g) + H2(g);
CO(g) + H2(g);
② 用天然气跟水蒸气反应:CH4(g) + H2O(g)  CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
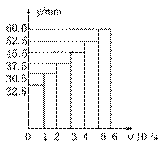
已知有关反应的能量变化如下图,且方法②的反应只能在高温下发生,
则方法②中反应的ΔH =___________ kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g) + N2(g)  2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 |
(1) 下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2) 甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3) 乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4) 分析上表数据,下列关系正确的是________.
a.2c1 = 3mol/L b.ω1 = ω2 c. 2ρ1 = ρ2
(5) 该温度下,容器乙中,该反应的平衡常数K=__________(用分数表示)(mol/L)-2。
(6) 常温下NH4+(aq) + H2O(l) 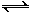 NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示。
电池正极的电极反应式是 ,A是 。
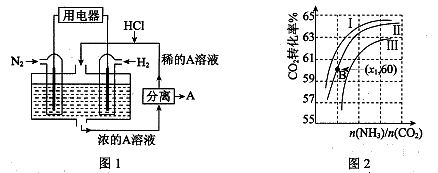
(2)用氨合成尿素的反应为2NH3(g) + CO2(g) 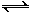 CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比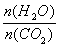 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量 浓度关系正确的是
浓度关系正确的是
A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO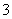 )>c(CO
)>c(CO )>c(H2CO3)
)>c(H2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO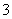 )+c(H2CO3)
)+c(H2CO3)
C. 向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO )>c(HCO
)>c(HCO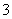 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1:
c(Na+)=0.1 mol·L-1:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是

A.图甲中t2时刻发生改变的条件是增大反应物的浓度
B.图甲中t2时刻发生改变的条件可能是增大压强
C.图乙中t2时刻发生改变的条件是升高温度
D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g
2NH3(g ) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是
) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是

A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯水的叙述中,正确的是
A.新制氯水中既有分子,又有离子
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水不能使干燥的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现“绿色化学实验”进课堂,某化学教师将钠与氯气反应的装置作如下改进:将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。
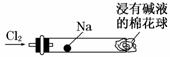
以下叙述中,错误的是
A.白烟中的固体小颗粒是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免污染空气
C.钠在氯气中着火燃烧产生苍白色火焰
D.发生的反应为2Na+Cl2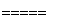 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。根据卤代烃的相关性质,回答下列问题.
 (1)化合物A的分子式是
(1)化合物A的分子式是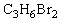 ,A的氢核磁共振氢谱图如图所示,则A的结构简式为 。
,A的氢核磁共振氢谱图如图所示,则A的结构简式为 。
(2)某同学用如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物。
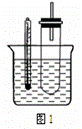
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和0.5 mL溴乙烷振荡。
实验操作Ⅱ:将试管如图1固定后,水浴加热。
①据图1:用水浴加热而不直接用酒精灯加热的原因是 。
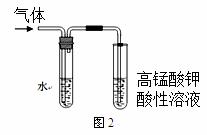
②图2是为证明溴乙烷在NaOH乙醇溶液中加热发生的是消去反应.
i实验中需要检验的产物是 ,水的作用是 ,实验现象是 。
ii若将“酸性高锰酸钾溶液”换成“Br2的CCl4溶液”,还需要装水的洗气装置吗? (填“需要”或“不需要”),理由是 。
iii所检验的产物与Br2的CCl4溶液反应的化学方程式为 。
| 物质 | 熔点/℃ | 沸点/℃ |
| CH3CH2Br | -119 | 38 |
| BrCH2CH2Br | 9 | 131 |
| CH3CH2OH | -114 | 78 |
⑶已知:
分离溴乙烷与1,2-二溴乙烷混合气体的方法是 。
a.冰水浴冷却→过滤 b.水浴冷却→蒸馏
c.冰水浴冷却→加水萃取→分液 d.水浴冷却→加水萃取→分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com