
某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)
A.4种 B.5种 C.6种 D.7种
科目:高中化学 来源: 题型:
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大.Z和N可以形成ZN2型化合物.下列有关说法正确的是( )
|
| A. | X与Y只能形成一种化合物 |
|
| B. | 最高价氧化物对应水化物的碱性:Y>Z |
|
| C. | 气态氢化物的热稳定性:M>N |
|
| D. | 单质的氧化性:X<M |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,反应2SO2(g)+O2(g) 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积 (SO3)随温度变化的曲线应为( )
(SO3)随温度变化的曲线应为( )
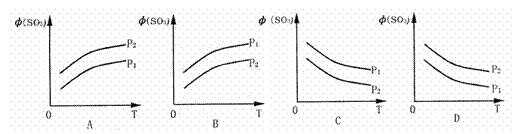
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能够完成相应实验的一项是
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 三脚架、泥三角、坩埚、坩埚钳 | 煅烧石灰石制取生石灰 |
| B | 烧杯、玻璃棒、胶头滴管、100 mL容量瓶 | 用浓盐酸配制100mL 0.1 mol·L-1的稀盐酸溶液 |
| C | 烧杯、玻璃棒、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42- 含量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是______________(填字母代号)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。

回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因 。
②过滤所得滤渣的主要成分为 。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为 。

④真空干燥MgSO4·7H2O晶体的原因是 。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
 ① 用焦炭跟水反应:C(s) + H2O(g)
① 用焦炭跟水反应:C(s) + H2O(g)  CO(g) + H2(g);
CO(g) + H2(g);
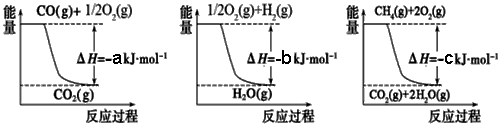
② 用天然气跟水蒸气反应:CH4(g) + H2O(g)  CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
已知有关反应的能量变化如下图,且方法②的反应只能在高温下发生,
则方法②中反应的ΔH =___________ kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g) + N2(g)  2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 |
(1) 下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2) 甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3) 乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4) 分析上表数据,下列关系正确的是________.
a.2c1 = 3mol/L b.ω1 = ω2 c. 2ρ1 = ρ2
(5) 该温度下,容器乙中,该反应的平衡常数K=__________(用分数表示)(mol/L)-2。
(6) 常温下NH4+(aq) + H2O(l)  NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
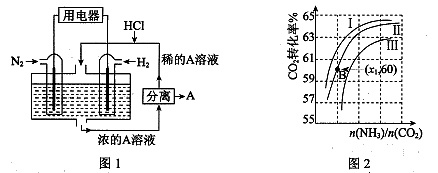
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示。
电池正极的电极反应式是 ,A是 。
(2)用氨合成尿素的反应为2NH3(g) + CO2(g) 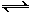 CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比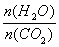 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示化学反应的离子方程式,其中正确的是
A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3
B.氯气通入冷水中:Cl2+H2O 2H++Cl- +ClO-
2H++Cl- +ClO-
C.苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O =2C6H5OH +CO32-
D.FeCl3溶液与Cu反应:2Fe3++Cu = 2Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
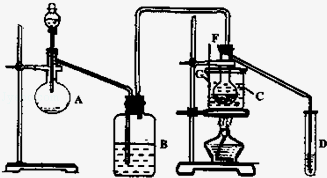
某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右)。但HgSO4遇到某些特定物质常会发 生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
(1)实验开始时,仪器A中盛放电石,B中应装入_______,其作用是_________ 。
(2)仪器D中盛放水,其作用是__________________________________________ 。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称_______________________ 。
(4)所选用温度计G的量程表示正确的是________ 。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.50℃~100℃
(5)检验乙醛已制出的操作、现象是______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g
2NH3(g ) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是
) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是

A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com