
�ȼҵ��������Ļ�ѧ��ҵ֮һ������Ҫԭ�����ڵ�ⱥ��ʳ��ˮ��2NaCl��2H2O 2NaOH��H2����Cl2�������IJ�Ʒ�ռ�������Լ�����Ӧ�ù㷺����ش��������⣺
2NaOH��H2����Cl2�������IJ�Ʒ�ռ�������Լ�����Ӧ�ù㷺����ش��������⣺
��1�����ǰ�����������SO42- �����ϸߣ��������ӱ��Լ���ȥSO42- ���ñ��Լ�������______________(����ĸ����)��
a��Ba(OH)2���� b��Ba(NO3)2���� c��BaCl2
��2�������ࡱ�ǵ��ʳ��ˮ�������γɵĹ�ҵ�����ϡ���ij����������������£�
| �ɷ� | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | ���������� |
| ��������(��) | 15��20 | 15��20 | 5��10 | 30��40 | 10��15 |
������������MgSO4��7H2O����Ĺ�����������ͼ��ʾ��

�ش��������⣺
����ϴ�����м��������������pHΪ5���ң���Ӧ�¶���50�����ҡ���������ʹ֮��ַ�Ӧ����ʹMg(OH)2����ܽⲢת��ΪMgSO4��CaCO3�ڴ˹�����ת��ΪCaSO4������ʹ�ת�����Է�����ԭ�� ��
�ڹ���������������Ҫ�ɷ�Ϊ ��
�۸�����ͼ�����������ᾧ�������þ���A��Ҫ�ɷ�Ϊ ��

����ո���MgSO4��7H2O�����ԭ���� ��
��3����֪NaCl��60 ����ܽ��Ϊ37.1 g���ֵ��60 �澫�Ʊ���ʳ��ˮ1371 g����������������Һ�ܶ�Ϊ1.37 g��cm-3�����к���20 g NaCl�������NaOH�����ʵ���Ũ��Ϊ________________mol��L-1��
��֪ʶ�㡿�����ᴿ�����ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ�� J5
���𰸽�������1��ac����ѡ������ѡ���ߴ�ѡһ�ɿ�1�֣�����Ϊֹ��
��2������������̼��Ʒ�Ӧ����������в�����CO2�����ݳ���̼���ת��Ϊ�����
��BaSO4��CaSO4�Ȳ�����������ʣ����BaSO4���ɣ�
��NaCl
�ܼ�Сѹǿ������ˮ�ķе㣬��������¶ȹ��߶�ʧȥ�ᾧˮ����ֹ�����¶ȹ���ʧȥ�ᾧˮ��1�֣�����ջ���ѹ����ˮ�ķе��1�֣�
��3��7.14��δ������λ��Ч���ֿ�һ�֣�
��������1����ȥSO42-Ӧ��Ba2+���ڳ��ӹ����в��������µ����ʣ���ֻ��ѡ��BaCl2��
��2�����ڴ˹�����������MgSO4•7H2O����Ӧ�������ᣬ�����������CaCO3������Ӧ����CO2���ڽ��������CO2�����ݳ���ʹƽ��CaCO3+H2SO4⇌CaSO4+H2O+CO2�����������ƶ�����ʹCaCO3ת��ΪCaSO4��
�ڹ��˵õ���������������ʣ���CaSO4��BaSO4���������ᣬ�ʹ���������������Ҫ�ɷ�ΪCaSO4��BaSO4�������������ʣ�
���ڴ˹������Ǹ����ڲ�ͬ�¶��²�ͬ���ʵ��ܽ�ȵIJ�ͬ�������е����ʳ������ʾ���A��Ҫ�ɷ�Ϊ�Ȼ��ƣ�
����ո���MgSO4•7H2O�����ֹʧȥ�ᾧˮ��
��3����1371gt��ʱ����ʳ��ˮ�к����Ȼ��Ƶ�����Ϊx��
1371 g/x=(100g+37.1g)/ 37.1 g
x=371g
������Һ�к���20 g NaCl���ʵ���NaCl������Ϊ371g��20 g=351g��
2NaCl+2H2O=2NaOH+H2��+Cl2��
117 80
351g m
117/351=80/m
m (NaOH)=240g
n (NaOH)=6mol
ͬ����������ļ�����Եõ����ɵ������������������ֱ�Ϊ6g��213g���ʵ������Һ������Ϊ1371 g��6g��213g=1152g��������Һ�����Ϊ1152g/1.37 g��cm-3=841mL=0.841L����NaOH�����ʵ���Ũ��C=n/V=7.14 mol��L-1
��˼·�㲦�����⿼���ˣ�1�����ʵķ����ᴿ����Ŀ�ѶȲ����ݳ����Dz��������µ����ʡ�����Ӱ�챻�ᴿ�����ʵ����ʺ��������Ҳ������У�����ʱҪ������ʵ��������ʺͻ�ѧ���ʽ��з��룻��2�����������ʵĻ�ѧ����ʽ������������������ļ��㣬�ѶȽϴ��㷴Ӧ����Һ����ʱ���÷�Ӧǰ��Һ������ȥ�������������ʱ������Ҫ��ȥ��������������Ҫ��ȥ�������������ʱ����ۺ��Խ�ǿ��


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ�������ȷ�Ӧ���ǣ�������
| �� | A�� | 2Mg+O2 | B�� | HCl+NaOH=NaCl+H2O |
| �� | C�� | C+H2O | D�� | CaO+H2O=Ca��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й��ڷ�Ӧ�ȵ�˵������ȷ���ǣ�������
A����֪�����Ȼ�ѧ����ʽ��2H2(g)+O2(g) === 2H2O(g) ��H����484kJ•mol-1��
��������ȼ����Ϊ242kJ•mol-1
B���кͷ�Ӧ��ʵ����H+ ��OH-�������ˮ�����������������ɣ��ⲿ�ַ�Ӧ�Ȳ����к�����
C�����ʵ�ȼ���ȿ�����������ʵ����
D���к��Ȳ����������ܽ⡢���롢ˮ�ϵȹ����е���ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£��������ˮϡ��������Һ�ĵ��������仯������ͼ��ʾ����ش�
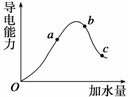
(1)��������O��ʱ�Ƿ�________�����ǻ�������� ��
(2)H�������ʵ���������________(�a������b����c��)��
(3)��ʹc����Һ�е�c(CH3COO-)�����Բ�ȡ���д�ʩ�е�________(�����)��
A������ B���Ӻ�ϡ��NaOH��Һ C����NaOH���� D����ˮ
E���ӹ���CH3COONa F������п��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵���������ȷ����
�ٴ�����ĽṹʽΪ H��Cl��O
�ں������Ӽ��Ļ����ﶼ�����ӻ�����
�۵����ʡ�Ư�ۡ����Լء�Һ���ֱ�Ϊ���������ǿ����ʺͷǵ����
�ܶ����ЧӦ������������Һ�ͽ��壬�ơ������ܲ��������ЧӦ
�����������ﲻһ���Ƿǽ�����������Ǽ���������һ���ǽ���������
A���٢ڢ� B���٢ۢ� C���ڢܢ� D���ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij���������л������ֻ��̼���⡢������Ԫ�أ���Է�������Ϊ58����ȫȼ��ʱ���������ʵ�����CO2��H2O�������ܵĽṹ���У������������칹��
A��4�� B��5�� C��6�� D��7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CoCl2��6H2O��һ������Ӫ��ǿ������һ������ˮ�ܿ�(��Ҫ�ɷ�ΪCo2O3��Co(OH)3����������Fe2O3��Al2O3��MnO��)��ȡCoCl2��6H2O�Ĺ����������£�
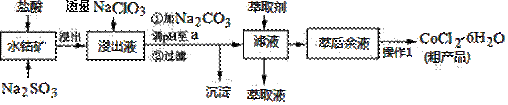
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���(��������Ũ��Ϊ��0.01mol/L)
| ������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| ��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
 ��CoCl2��6H2O�۵�Ϊ86�棬������110~120��ʱ��ʧȥ�ᾧˮ������ˮ�Ȼ��ܡ�
��CoCl2��6H2O�۵�Ϊ86�棬������110~120��ʱ��ʧȥ�ᾧˮ������ˮ�Ȼ��ܡ�
(1)д������������Co2O3������Ӧ�����ӷ���ʽ________________________��
(2)д��NaClO3������Ӧ����Ҫ���ӷ���ʽ_____________________________������������Һ���мӹ���NaClO3ʱ�����ܻ������ж����壬д�����ɸ��ж���������ӷ���ʽ______________________________________��
(3)����Na2CO3��pH��a��,�������õ��ij����ɷ�Ϊ ��
(4)������1���а���3������ʵ�����������������_________��__________���ˡ��Ƶõ�CoCl2��6H2O�ں��ʱ���ѹ��ɵ�ԭ����__________________��
(5)��ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ������Һ���м�����ȡ����Ŀ����___________________����ʹ�õ����pH��Χ��_________��
A��2.0~2.5 B��3.0~3.5
C��4.0~4.5 D��5.0~5.5
(6)Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡһ�������Ĵֲ�Ʒ����ˮ����������AgNO3��Һ�����ˡ�ϴ�ӣ���������ɺ����������ͨ�����㷢�ֲִ�Ʒ��CoCl2��6H2O��������������100������ԭ�������_____________________������һ�����ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�ʵ��ԭ���������ȷ����
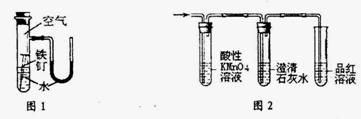
A����ͼ1װ����֤�ڸ���������������������ʴ
B����ʪ�����ɫʯ����ֽ���鰱��
C����20mL��Ͳ��ȡ15mL�ƾ�����ˮ5mL��������������Ϊ75%�ƾ���Һ
D����ͼ2װ�ü���ʵ�����Ƶõ���ϩ�л���SO2��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���淴Ӧ��2NO2 2NO+O2 ���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ��� ��
2NO+O2 ���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ��� ��
�ٵ�λʱ��������n molO2��ͬʱ����2n molNO2
�ڵ�λʱ��������n molO2 ��ͬʱ������2n mol NO
����NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2 : 2 : 1��״̬
�ܻ���������ɫ���ٸı��״̬ �ݻ��������ܶȲ��ٸı��״̬
�� ��������ƽ����Է����������ٸı��״̬
A�� �٢ܢ� B���ڢۢ� C���٢ۢ� D�� �٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com