
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
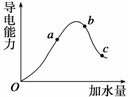
(1)冰醋酸在O点时是否导电________(填是或否),理由是 。
(2)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(3)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
A.加热 B.加很稀的NaOH溶液 C.加NaOH固体 D.加水
E.加固体CH3COONa F.加入锌粒
科目:高中化学 来源: 题型:
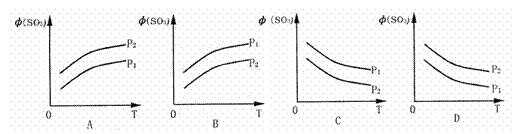
如图所示,反应2SO2(g)+O2(g) 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积 (SO3)随温度变化的曲线应为( )
(SO3)随温度变化的曲线应为( )
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)  C(g)+D(s)。达到平衡时,测得压强为原压强的
C(g)+D(s)。达到平衡时,测得压强为原压强的 。则A的转化率为
。则A的转化率为
A.25% B.40% C.50% D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能够完成相应实验的一项是
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 三脚架、泥三角、坩埚、坩埚钳 | 煅烧石灰石制取生石灰 |
| B | 烧杯、玻璃棒、胶头滴管、100 mL容量瓶 | 用浓盐酸配制100mL 0.1 mol·L-1的稀盐酸溶液 |
| C | 烧杯、玻璃棒、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42- 含量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是______________(填字母代号)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。

回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因 。
②过滤所得滤渣的主要成分为 。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为 。

④真空干燥MgSO4·7H2O晶体的原因是 。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示化学反应的离子方程式,其中正确的是
A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3
B.氯气通入冷水中:Cl2+H2O 2H++Cl- +ClO-
2H++Cl- +ClO-
C.苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O =2C6H5OH +CO32-
D.FeCl3溶液与Cu反应:2Fe3++Cu = 2Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
图中曲线1表示_______的分布系数变化;曲线2表示________的分布系数变化。 现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4 ③H2C2O4 ④(NH4)2C2O4 ⑤NH4HC2O4 已知NaHC2O4溶液显酸性。
(1) Na2C2O4溶液中,c(Na+)/ c(C2O42-) 2 (填“>”、“=”、“<”),原因是
Na2C2O4溶液中,c(Na+)/ c(C2O42-) 2 (填“>”、“=”、“<”),原因是
(用离子方程式表示)。
(2)常温下,向10 mL 0. 1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显_____性(填“酸”、“碱”或“中”),且V(NaOH)______10 mL(填“>”、“=”或“<”)。
(3)下列关于五种溶液的说法中,正确的是( )
A.溶液②中,c(C2O42-) < c(H2C2O4)
B.溶液②中,c(H2C2O4)+ c(OH-) = c(C2O42-)+ c(H+)
C.溶液④⑤中都符合c(NH4+)+ c(H+)= c(HC2O4-)+2 c(C2O42-)+ c(OH-)
D.五种溶液都符合c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)= 0.1 mol·L-1 .
(4)五种溶液中c(H2C2O4)由大到小排列的顺序是____________________。
 (5)配平氧化还原反应方程式:
(5)配平氧化还原反应方程式:
称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20 mL时,溶液由无色变为浅 红色。第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16 mL时恰好反应完全。则原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________。
红色。第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16 mL时恰好反应完全。则原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com