
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为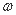 ,物质的量浓度为c mol·L-1。则下列选项不正确的是
,物质的量浓度为c mol·L-1。则下列选项不正确的是
A.溶质的质量分数为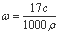
B.用水稀释该溶液,OH- 的物质的量增加
C.该溶液中共有6种微粒
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5
【知识点】物质的量浓度的相关计算;溶液中溶质的质量分数及相关计算 A4
【答案解析】D 解析:A.氨水溶液溶质为氨气,设该溶液的体积为1L,所以溶液质量为1000ρg,溶质氨气的质量为17cg,溶质的质量分数 ,故A正确;
,故A正确;
B.用水稀释该溶液,溶液中的一水合氨的电离程度增大故OH- 的物质的量增加,故B正确;
C、该溶液中含有NH4+ 、OH-、H+、NH3、H2O和NH3·H2O6种微粒,正确;
D.水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,根据溶质的质量分数=m(溶质)/ m(溶液)×100%可知,等体积混合所得溶液溶质的质量分数小于0.5ω,故D错误。
【思路点拨】本题考查了溶液浓度的相关计算,同时也涉及到了电离平衡、弱电解质的电离问题,综合性较强。


科目:高中化学 来源: 题型:
下列关于强弱电解质的叙述错误的是 ( )
A.弱电解质在溶液中部分电离,存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2
NaNO2+HF==HCN+NaF NaNO2+HF==HNO2+NaF
由此可判断下列叙述中正确的是( )
A. HF的电离常数是① B. HNO2的电离常数是①
C. HCN的电离常数是② D. HNO2的电离常数是③
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能够完成相应实验的一项是
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 三脚架、泥三角、坩埚、坩埚钳 | 煅烧石灰石制取生石灰 |
| B | 烧杯、玻璃棒、胶头滴管、100 mL容量瓶 | 用浓盐酸配制100mL 0.1 mol·L-1的稀盐酸溶液 |
| C | 烧杯、玻璃棒、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生产、生活紧切相关。下列说法正确的是
A.石英只能用于生产光导纤维
B.从海水提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.淀粉、纤维素和脂肪在一定条件下都可以发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
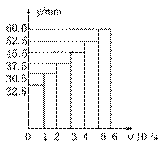 ① 用焦炭跟水反应:C(s) + H2O(g)
① 用焦炭跟水反应:C(s) + H2O(g)  CO(g) + H2(g);
CO(g) + H2(g);
② 用天然气跟水蒸气反应:CH4(g) + H2O(g)  CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
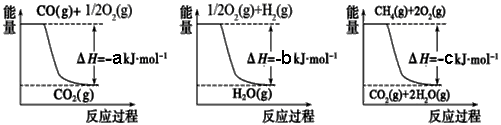
已知有关反应的能量变化如下图,且方法②的反应只能在高温下发生,
则方法②中反应的ΔH =___________ kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g) + N2(g)  2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 |
(1) 下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2) 甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3) 乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4) 分析上表数据,下列关系正确的是________.
a.2c1 = 3mol/L b.ω1 = ω2 c. 2ρ1 = ρ2
(5) 该温度下,容器乙中,该反应的平衡常数K=__________(用分数表示)(mol/L)-2。
(6) 常温下NH4+(aq) + H2O(l)  NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
NH3•H2O(aq) + H+(aq)的化学平衡常数为5.55×10—10 mol·L—1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。已知草酸的电离常数为:Ka1=5.9×10—2 Ka2=6.4×10—5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:________________________________________。
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示。
电池正极的电极反应式是 ,A是 。
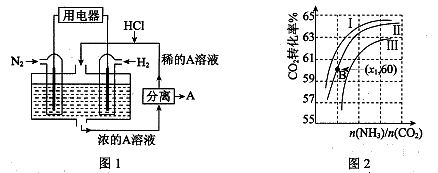
(2)用氨合成尿素的反应为2NH3(g) + CO2(g) 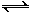 CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(s)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比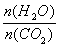 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是

A.图甲中t2时刻发生改变的条件是增大反应物的浓度
B.图甲中t2时刻发生改变的条件可能是增大压强
C.图乙中t2时刻发生改变的条件是升高温度
D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com