
| ѡ�� | ���� | ���� |
| A | ��ǿ�������ȡ������ | CO2ͨ��NaClO��Һ��������HClO |
| B | ������Һ��pH����Һ����ԵĹ�ϵ | pH=6.8����Һһ�������� |
| C | �ṹ��������Ƶ����ʣ��е�����Է���������������� | NH3�е����PH3 |
| D | ͬ����Ԫ�ش������·ǽ����Լ��� | HF��HCl��HBr��HI���������μ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A��ǿ���ܺ������η�Ӧ�������ᣬ̼�����Դ��ڴ����
B��Ҫ������Һ��c��H+����c��OH-����Դ�Сȷ����Һ����ԣ��¶�δ֪ʱ���ܸ�����ҺpH�жϣ�
C���⻯����۷е�����Ӽ�������������йأ�
D��±��Ԫ���У���ǽ�����Խǿ�����⻯���л�ѧ��Խǿ�����⻯����ˮ��Һ��Խ�ѵ��룮
��� �⣺A��ǿ���ܺ������η�Ӧ�������ᣬ̼�����Դ��ڴ����ᣬ���Զ�����̼�ܺʹ���������Һ��Ӧ���ɴ����ᣬ��A��ȷ��
B��Ҫ������Һ��c��H+����c��OH-����Դ�Сȷ����Һ����ԣ��¶�δ֪ʱ���ܸ�����ҺpH�жϣ�pH=6.8����Һ��һ��Ϊ������Һ�������Ǽ�����Һ����100��ʱ��ˮ��pH=6������¶���pH=6.8����Һ�ʼ��ԣ���B����
C���⻯����۷е�����Ӽ�������������йأ������к�������������в��������NH3�е����PH3����C����
D��±��Ԫ���У���ǽ�����Խǿ�����⻯���л�ѧ��Խǿ�����⻯����ˮ��Һ��Խ�ѵ��룬�ǽ����Դ�F��I�����������⻯���ˮ��Һ������ǿ����D����
��ѡA��
���� ���⿼��Ԫ�������ɣ�Ϊ��Ƶ���㣬�漰ǿ����ȡ���ᡢ��Һ������жϡ��⻯���۷е��жϡ��ǽ����������⻯��ˮ��Һ����ǿ���жϵ�֪ʶ�㣬��ȷ�������ʡ�Ԫ���������ǽⱾ��ؼ���ע�⣺�⻯����۷е�������ͷ��Ӽ��������йأ����⻯����ȶ����뻯ѧ���йأ�ע�����������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ȴ���������ʴ | |
| B�� | ����ԭ��ص������������������ֲ�ͬ�Ľ��� | |
| C�� | �������ڿ����б��潥���䰵����Ϊ������ԭ��ط�Ӧ | |
| D�� | ����صij�ŵ���������������Ĺ���ԭ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 16O2��18O2��Ϊͬ���칹�� | |
| B�� | 16O��18O��������Ų���ʽ��ͬ | |
| C�� | 16O��18O����������ͬ | |
| D�� | ��״���£�1.12 L 16O2��1.12 L 18O2����0.1 NA ����ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
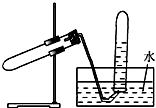 ��ͼ��ʾװ�ÿ����ڣ�������
��ͼ��ʾװ�ÿ����ڣ�������| A�� | ����NaHCO3��CO2 | B�� | ��Cu��ŨHNO3��Ӧ��NO2 | ||
| C�� | ��Zn��ϡ���ᷴӦ��H2 | D�� | ��NaCl��ŨH2SO4������HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ͷ��ˮ�У�Na+2H2O�TNa++2OH-+H2�� | |
| B�� | ���ҽ���Һ�м������ᡢ˫��ˮ��2I-+2H++H2O2�TI2+2H2O | |
| C�� | ̼��������ϡ���ᷴӦ��CO32-+2H+�TH2O+CO2�� | |
| D�� | ��NaAlO2��Һ��ͨ�����CO2��2AlO2-+CO2+3H2O�T2Al��OH��3��+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
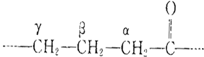

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
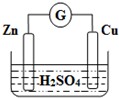
| A�� | Zn�Ǹ�����Cu������ | B�� | ϡ������Һ��H+����Zn�� | ||
| C�� | ������ͭƬͨ����������пƬ | D�� | ��װ���ܽ�����ת��Ϊ��ѧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/min | 0 | 2 | 4 | 6 |
| V�� 02 ��/mL | 0.0 | 9.9 | 17.2 | 22.4 |
| A�� | 0-2min��ƽ����Ӧ���ʱ�4-6min�� | |
| B�� | 0-6min ��ƽ����Ӧ����v�� H2O2��=3.3 x 10-2 moL-1•min-1 | |
| C�� | ��Ӧ�� 6min ʱ��c�� H2O2��=0.3mol•L-1 | |
| D�� | ��Ӧ��6minʱ��H2O2�ֽ��� 50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ��FeBr3�������������������屽 | |
| B�� | ��������Ҵ��������������ɱ���������ˮ���Ʊ�������Ҵ��ķ�Ӧ���Ͳ�ͬ | |
| C�� | ��ϩ�����뱽�����е�̼̼����ͬ�������߶��ܷ����ӳɷ�Ӧ | |
| D�� |  ��CH3CH2OH��Ϊͬϵ�� ��CH3CH2OH��Ϊͬϵ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com