
【题目】人类过多地使用化石燃料,造成了二氧化碳的大量排放,致使地球气温上升。二氧化碳是温室气体,也是一种重要的资源,如以CO2为基本原料可合成甲醇。回答下列问题:
(1)已知下列热化学方程式:
ⅰ.![]()
![]()
ⅱ.![]()
![]()
则ⅲ.![]()
![]() ________
________![]()
(2)Deluzarche等人在吸附有氢气的![]() 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:

其中涉及非极性键变化的过程是______(填上图中的数字序号),写出上述过程中总反应的化学方程式:_____。
(3)一定条件下,向某密闭容器中按照![]() 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:

由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率________(填“减小”“不变”或“增大”),温度为265℃时的平衡常数Kp=________![]() (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(4)将一定量的![]() 、
、![]() 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成![]() ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中![]() 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。

则A、B、C三点的平衡常数由大到小的顺序为____(用![]() 、
、![]() 、
、![]() 表示),E点变为D点的措施是____。
表示),E点变为D点的措施是____。
(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液,![]() 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
【答案】-49.6 ① 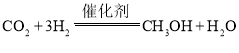 增大 0.0036
增大 0.0036 ![]() 减小压强
减小压强 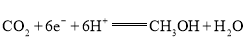
【解析】
(1)根据盖斯定律计算反应ⅲ的焓变;
(2)根据流程图,氢气、CO2在![]() 催化剂表面上反应生成CH3OH;
催化剂表面上反应生成CH3OH;
(3)根据b点,温度为265℃、压强为8MPa,甲醇的百分含量为10%,利用“三段式”计算平衡常数;
(4)升高温度,甲醇的体积分数减小,说明升高温度平衡逆向移动;平衡常数只与温度有关;
(5) ![]() 生成甲醇,碳元素化合价由+4降低为-2,CO2得电子发生还原反应生成甲醇;
生成甲醇,碳元素化合价由+4降低为-2,CO2得电子发生还原反应生成甲醇;
(1)ⅰ.![]()
![]()
ⅱ.![]()
![]()
根据盖斯定律ⅰ×![]() +ⅱ×
+ⅱ×![]() 得
得![]()
![]()
![]() -49.6
-49.6![]() ;
;
(2)根据流程图,①是H-H键断裂,涉及非极性键变化的是过程①;氢气、CO2在![]() 催化剂表面上反应生成CH3OH,总反应的化学方程式是
催化剂表面上反应生成CH3OH,总反应的化学方程式是 ;
;
(3)根据图示,压强增大,CO2的转化率增大;
根据b点,温度为265℃、压强为8MPa,甲醇的百分含量为10%;
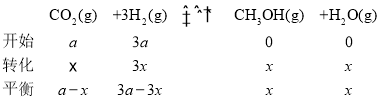
![]() ,x=
,x=![]() ;则平衡时CO2的压强为
;则平衡时CO2的压强为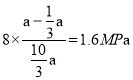 、则平衡时H2的压强为
、则平衡时H2的压强为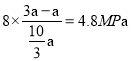
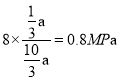 、则平衡时H2O的压强为
、则平衡时H2O的压强为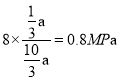 ,温度为265℃时的平衡常数Kp=
,温度为265℃时的平衡常数Kp=![]() 0.0036
0.0036![]() ;
;
(4)升高温度,甲醇的体积分数减小,说明升高温度平衡逆向移动,所以升高温度K减小,所以![]() >
>![]() ; 平衡常数只与温度有关,所以
; 平衡常数只与温度有关,所以![]() =
=![]() ,故
,故![]() ;减小压强,平衡逆向移动,甲醇体积分数减小,所以E点变为D点的措施是减小压强;
;减小压强,平衡逆向移动,甲醇体积分数减小,所以E点变为D点的措施是减小压强;
(5) ![]() 生成甲醇,碳元素化合价由+4降低为-2, 1molCO2得6mol电子生成1mol甲醇,生成甲醇的电极反应式是
生成甲醇,碳元素化合价由+4降低为-2, 1molCO2得6mol电子生成1mol甲醇,生成甲醇的电极反应式是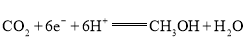 。
。


科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列说法正确的是
A.ΔH1<0,ΔH2>0
B.反应①②③的反应热满足关系:ΔH1-ΔH2=ΔH3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法将HCl气体直接氧化成Cl2,方程式为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
(1)该反应的平衡常数表达式为___,K(300℃)___K(400℃)(填“<”,“=”或“>”)。
(2)若平衡时a(HCl)为80%,在相同条件下,密闭容器的体积缩小为1L,此反应达平衡时放出的热量(Q)可能是___(填字母序号)kJ。
A.0<Q<58 B.92.8<Q<116 C.371.2<Q<464 D.116<Q<232
(3)在一定条件下,体系中HCl的平衡转化率与L和X的关系如图所示,L和X分别表示温度或压强。

i.X表示的物理量是___。
ii.判断L1与L2的大小关系:L1___L2(填“<”,“=”或“>”)。
(4)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0,反应物HCl的转化率a(HCl)为___(请用P0、P来表示),有利于提高HCl平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 。室温下,向浓度为0.1mol·L-1的氨水中缓缓通入HCl,
。室温下,向浓度为0.1mol·L-1的氨水中缓缓通入HCl,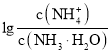 随pOH的变化曲线如下图所示。假设溶液体积没有变化,下列推断正确的是( )
随pOH的变化曲线如下图所示。假设溶液体积没有变化,下列推断正确的是( )
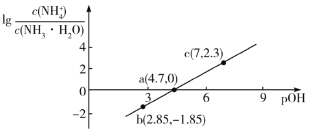
A.NH3·H2O的电离常数的数量级为10-4
B.b点溶液中:![]()
C.c点溶液中:![]()
D.pOH=8的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依伐卡托(Ivacaftor)是一种新型药物,其结构简式是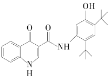 ,该药物的一种合成路线如下:
,该药物的一种合成路线如下:
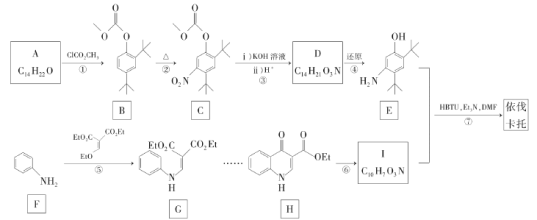
已知:ⅰ.Et—为乙基;
ⅱ.![]() 。
。
回答下列问题:
(1)①的反应类型是________,该反应在该合成路线中的作用是________。
(2)反应②需要的试剂是________。
(3)D的结构简式为________,其含有的官能团名称为________。
(4)A的同分异构体较多,其中X含有苯环,能与FeCl3溶液发生显色反应,核磁共振氢谱中有4组峰,峰面积之比为9:6:6:1,则X的结构简式为________。
(5)反应⑦的化学方程式为____________。
(6)设计由苯和乙烯为原料制备 的合成路线:_______________(其他试剂任选)。
的合成路线:_______________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可形象地描述为交换舞伴(如图所示):

烯烃复分解反应中的催化剂是金属卡宾(如CH2=M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。根据以上信息进行判断,如果把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是 ( )
A. C6H5CH2CH=M B. CH2=CH2
C. C6H5CH2CH2C6H5 D. C6H5CH2CH=CHCH2C6H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
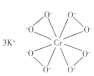
(1)基态Cr原子的未成对电子数为________________。
(2)![]() 的结构如图所示。
的结构如图所示。
①下列有关![]() 的说法正确的是__________(填标号)。
的说法正确的是__________(填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,![]() 。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
(3)雷氏盐的化学式为![]() 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________。
②其阳离子的中心原子的杂化方式为_________________,配体之一NH3分子的立体构型为______。
③与配体NCSˉ互为等电子体的阴离子有![]() 等,分子有_____________________(写1种);画出
等,分子有_____________________(写1种);画出![]() 的结构式:_____________________________。
的结构式:_____________________________。
(4)![]() 的晶体密度为
的晶体密度为![]() ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为![]() ,高为
,高为![]() ,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
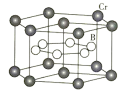
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
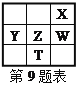
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com