
【题目】![]() 、
、![]() 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
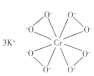
(1)基态Cr原子的未成对电子数为________________。
(2)![]() 的结构如图所示。
的结构如图所示。
①下列有关![]() 的说法正确的是__________(填标号)。
的说法正确的是__________(填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,![]() 。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
(3)雷氏盐的化学式为![]() 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________。
②其阳离子的中心原子的杂化方式为_________________,配体之一NH3分子的立体构型为______。
③与配体NCSˉ互为等电子体的阴离子有![]() 等,分子有_____________________(写1种);画出
等,分子有_____________________(写1种);画出![]() 的结构式:_____________________________。
的结构式:_____________________________。
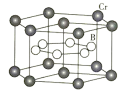
(4)![]() 的晶体密度为
的晶体密度为![]() ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为![]() ,高为
,高为![]() ,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
【答案】6 AC 140 Oˉ带负电荷,对再得到的电子产生排斥,克服斥力需消耗能量 O>N>C>H ![]() 三角锥形 CO2(或CS2、N2O等)
三角锥形 CO2(或CS2、N2O等) ![]()
【解析】
(1)根据基态Cr原子核外电子排布分析;
(3)①非金属性越强,电负性越大;
②根据价层电子对互斥理论判断;
③根据同族替换和等量代换原则找等电子体;
(4)根据均摊法确定晶胞所含微粒个数,从而确定晶胞质量,根据![]() 计算晶胞体积,根据几何知识根据晶胞体积计算a2c。
计算晶胞体积,根据几何知识根据晶胞体积计算a2c。
(1)Cr是24号元素,其原子核外有24个电子,根据能量最低原理可写出电子排布式为1s22s22p63s23p63d54s1,Cr原子有6个未成对电子;
(2)①钾离子和CrO![]() 之间形成离子键,O原子之间为σ键,不含π键;根据共价键的饱和性,O原子可以形成2个共价键,图示结构氧原子形成3个单键,说明有一个配位键,O原子提供孤电子对,Cr3+提供空轨道;据图可知该物质中O原子之间形成过氧键,所以O元素化合价为-1价,根据电中性原则可知Cr为+5价,综上所述选AC;
之间形成离子键,O原子之间为σ键,不含π键;根据共价键的饱和性,O原子可以形成2个共价键,图示结构氧原子形成3个单键,说明有一个配位键,O原子提供孤电子对,Cr3+提供空轨道;据图可知该物质中O原子之间形成过氧键,所以O元素化合价为-1价,根据电中性原则可知Cr为+5价,综上所述选AC;
②根据![]() 可知氧的第一电子亲和能E1为140 kJ/mol;
可知氧的第一电子亲和能E1为140 kJ/mol;
Oˉ带负电荷,对再得到的电子产生排斥,克服斥力需消耗能量,所以△H2>0;
(3)①非金属性O>N>C>H,所以电负性O>N>C>H;
②其阳离子为NH![]() ,中心原子的价层电子对数为
,中心原子的价层电子对数为![]() =4,为sp3杂化;NH3分子的中心原子价层电子对数为4,含一对孤电子对,所以立体构型为三角锥形;
=4,为sp3杂化;NH3分子的中心原子价层电子对数为4,含一对孤电子对,所以立体构型为三角锥形;
③NCSˉ价电子数为16,原子数为3,用S、O代替Nˉ可得互为等电子的分子有CO2、CS2,同理还有N2O;F电负性较强,容易形成氢键,根据共价键的饱和性可知![]() 中有氢键,所以其结构式为
中有氢键,所以其结构式为![]() ;
;
(4)根据均摊法,晶胞中Cr的数目为![]() =3,B的数目为6,所以晶胞的质量为m=
=3,B的数目为6,所以晶胞的质量为m=![]() ,根据几何知识,晶胞的体积为V=
,根据几何知识,晶胞的体积为V=![]() nm3,晶胞的密度
nm3,晶胞的密度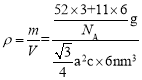 ,解得a2c=
,解得a2c=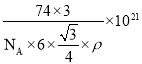 cm3
cm3


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】甲烷的分子结构模型如图所示:

根据甲烷的分子结构模型,回答问题:
(1)甲烷的电子式是__,其含义是__。
(2)甲烷的结构式是__,其含义是_。
(3)甲烷分子的空间构型是__。
(4)更能真实反映甲烷分子结构模型的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类过多地使用化石燃料,造成了二氧化碳的大量排放,致使地球气温上升。二氧化碳是温室气体,也是一种重要的资源,如以CO2为基本原料可合成甲醇。回答下列问题:
(1)已知下列热化学方程式:
ⅰ.![]()
![]()
ⅱ.![]()
![]()
则ⅲ.![]()
![]() ________
________![]()
(2)Deluzarche等人在吸附有氢气的![]() 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:

其中涉及非极性键变化的过程是______(填上图中的数字序号),写出上述过程中总反应的化学方程式:_____。
(3)一定条件下,向某密闭容器中按照![]() 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:

由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率________(填“减小”“不变”或“增大”),温度为265℃时的平衡常数Kp=________![]() (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(4)将一定量的![]() 、
、![]() 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成![]() ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中![]() 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。

则A、B、C三点的平衡常数由大到小的顺序为____(用![]() 、
、![]() 、
、![]() 表示),E点变为D点的措施是____。
表示),E点变为D点的措施是____。
(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液,![]() 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。酒精喷灯可用作高温热源。正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。请回答下列问题:
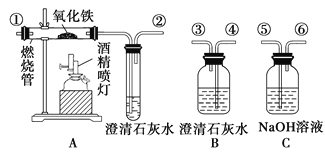
(1)连接装置导管口的顺序:混合气体→__________________→尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是__________________________________;
证明CO存在的有关反应的化学方程式是__________________________________________。
(3)有同学提出仪器B应再使用一次,你认为有道理吗?________(填“有”或“没有”),并简述理由:
_________________________________________________________________。
(4)本实验尾气处理的方法是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,该药物通常以 2-氯苯甲醛为原料合成,合成路线如下:
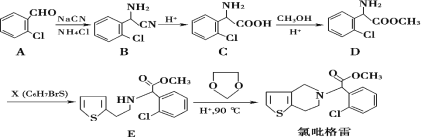
(1)下列关于氯吡格雷的说法正确的是__________。
A.氯吡格雷在一定条件下能发生消去反应
B.氯吡格雷难溶于水,在一定条件下能发生水解反应
C.1mol氯吡格雷含有5NA个碳碳双键,一定条件下最多能与5molH2发生加成反应
D.氯吡格雷的分子式为C16H16ClNO2S
(2)物质 D 的核磁共振氢谱有_________种吸收峰。
(3)物质 X 的结构简式为____________。
(4)物质 C可在一定条件下反应生成一种含有 3个六元环的产物,写出该反应的化学方程式______,反应类型是__________。
(5)写出属于芳香族化合物 A的同分异构体__________(不包含 A)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室以乙醇为原料来制备乙酸乙酯时,经历了下面三步反应:
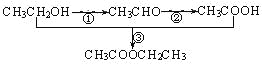
下列说法正确的是
A.乙醇和乙醛能发生氧化反应,乙酸和乙酸乙酯则不能被氧化
B.上述①、②、③的反应类型分别是氧化反应、加成反应和取代反应
C.上述乙醇、乙酸和乙酸乙酯都具有同分异构体
D.工业上可以通过石油分馏的方法获得乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,A(g)+3B(g)![]() 5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是

A.加入适当催化剂B.增大压强C.增大反应物的浓度D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
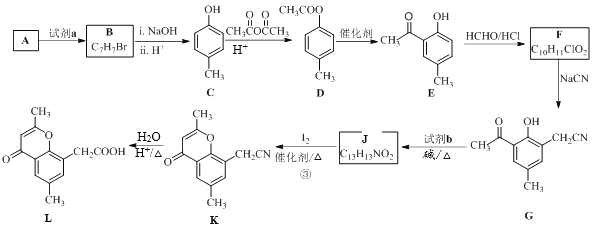 已知部分有机化合物转化的反应式如下:
已知部分有机化合物转化的反应式如下:
i.R-X![]() R-CN
R-CN![]() R-COOH(R为烃基)
R-COOH(R为烃基)
ii.RCHO+CH3COR′![]() RCH=CHCOR′(R、R′代表烃基或氢)
RCH=CHCOR′(R、R′代表烃基或氢)
iii.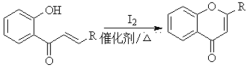 (R代表烃基或氢)
(R代表烃基或氢)
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)试剂a是_______________。
(3)C→D的化学方程式是___________________。
(4)F的结构简式是__________;试剂b是___________。
(5)J与I2反应生成K和HI的化学方程式是____________。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线_______________。
),参照下列模板写出相应的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设N为阿伏加德罗常数的值。下列说法正确的是( )
A.密闭容器中![]() 和
和![]() 催化反应后原子总数小于
催化反应后原子总数小于![]()
B.![]() 的浓盐酸与足量
的浓盐酸与足量![]() 共热,电子转移的数目为
共热,电子转移的数目为![]()
C.向![]() 溶液中滴加氨水至溶液呈中性混合液中
溶液中滴加氨水至溶液呈中性混合液中![]() 的数目为
的数目为![]()
D.在标准状况下,![]() 二氯乙烷(
二氯乙烷(![]() )中含有极性键的数目为
)中含有极性键的数目为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com