
【题目】设N为阿伏加德罗常数的值。下列说法正确的是( )
A.密闭容器中![]() 和
和![]() 催化反应后原子总数小于
催化反应后原子总数小于![]()
B.![]() 的浓盐酸与足量
的浓盐酸与足量![]() 共热,电子转移的数目为
共热,电子转移的数目为![]()
C.向![]() 溶液中滴加氨水至溶液呈中性混合液中
溶液中滴加氨水至溶液呈中性混合液中![]() 的数目为
的数目为![]()
D.在标准状况下,![]() 二氯乙烷(
二氯乙烷(![]() )中含有极性键的数目为
)中含有极性键的数目为![]()
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
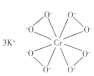
(1)基态Cr原子的未成对电子数为________________。
(2)![]() 的结构如图所示。
的结构如图所示。
①下列有关![]() 的说法正确的是__________(填标号)。
的说法正确的是__________(填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,![]() 。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
(3)雷氏盐的化学式为![]() 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________。
②其阳离子的中心原子的杂化方式为_________________,配体之一NH3分子的立体构型为______。
③与配体NCSˉ互为等电子体的阴离子有![]() 等,分子有_____________________(写1种);画出
等,分子有_____________________(写1种);画出![]() 的结构式:_____________________________。
的结构式:_____________________________。
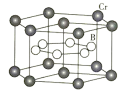
(4)![]() 的晶体密度为
的晶体密度为![]() ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为![]() ,高为
,高为![]() ,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
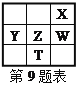
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应N2(g)+3H2(g)![]() 2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
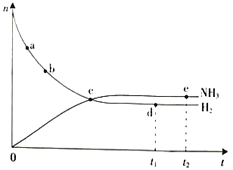
A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.点d(t1时刻)和点e(t2时刻)处正逆速率不相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
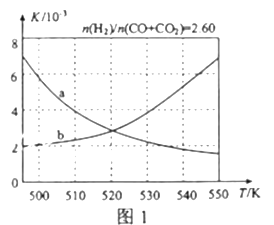 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为

下列说法正确的是( )
A. 上述反应为取代反应 B. 脱氢维生素C的分子式为C6H5O6
C. 滴定时应剧烈振荡锥形瓶 D. 滴定时可用淀粉溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是制作光伏电池的关键材料。在Si晶体中掺杂不同种类的元素,可形成多电子的n型或缺电子的p型半导体。n型和p型半导体相互叠加形成p-n结,此时自由电子发生扩散运动,在交界面处形成电场。下列说法正确的是
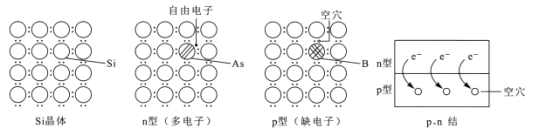
A.1molSi晶体中含有的Si-Si键数目为4NA
B.若在Si晶体中掺入P元素,可得n型半导体
C.p-n结中,n型一侧带负电,p型一侧带正电
D.光伏电池的能量转化形式为:光能→化学能→电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
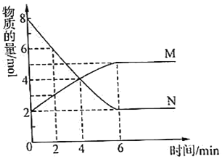
(1)反应的化学方程式为___。
(2)反应达到最大限度的时间是__min,该时间内的平均反应速率υ(N)=__。
(3)反应达到平衡状态时,放出6QkJ的热量。若容器开始时充入lmolN,反应放出的热量为__。
A.等于QkJ B.小于QkJ C.大于QkJ D.等于2QkJ
(4)判断该反应达到平衡状态的依据是___。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的平均摩尔质量不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是___。
①升高温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④使用催化剂
(6)一定温度下,将一定量的N2和H2充入2L固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com