
下图是部分短周期元素的常见化合价与原子序数的关系图:
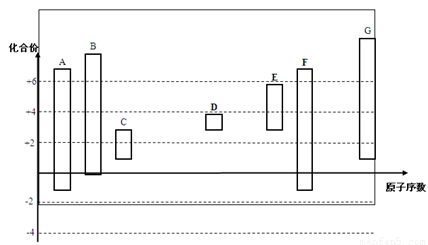
(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 其所含化学键类型为 。
(3)C2-、D+、G2-离子半径大小顺序是 > > (用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。

① 溶液a和b分别为 , 。
② 溶液c中的离子方程式为 。
③ 请从原子结构的角度解释非金属性B > A的原因 。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为 。
② 用一个离子方程式表示该反应 。
(1)第二周期ⅣA族(1分)
(2) (1分) 离子键(1分)
(1分) 离子键(1分)
(3) S2->O2->Na+ (1分)
(4)① 硝酸(HNO3)(1分) 饱和NaHCO3溶液(1分,缺少“饱和”不给分)
② SiO2- 3+CO2+H2O=H2SiO3↓+CO2- 3 (写H4SiO4也给分)(1分)
③ 碳和氮元素处于同一周期,氮原子的核电荷数大于碳原子,原子半径较碳原子小,氮原子核对最外层电子的吸引力更大,得电子能力更强,因此氮元素的非金属性强于碳元素。 (2分)
(5)①0.5 mol (1分)
②10Na2O2 + 6Al3+ + 6H2O = 4Al(OH)3 + 2AlO-2+ 5O2↑+ 20Na+ (2分)
【解析】
试题分析:根据最高正价=最外层电子数,最低负价=最外层电子数-8(F、O无正价),结合原子序数可知:A、C;B、N;C、O;D、Na;E、Al;F、Si;G、S。
(1)C位于第二周期ⅣA族
(2)Na2S的形成过程 ,含有离子键。
,含有离子键。
(3) S2-有3个电子层,O2-和Na+只有2个电子层(电子层结构相同,序数越大,半径越小),
所以:S2->O2->Na+ 。
(4)非金属性强弱与最高价氧化物的水化物的酸性强弱有关,C、N、Si的最高价氧化物的水化物分别为H2CO3、HNO3、H2SiO3,而在溶液中一般遵循强酸制弱酸的原理。所以溶液a为HNO3、固体a为Na2CO3、溶液b为饱和NaHCO3溶液,用于除去CO2中的HNO3,溶液c为Na2SiO3。
(5)①电子转移发生在Na2O2中的O,每个Na2O2转移1个电子,所以0.5 mol Na2O2转移电子0.5 mol;
②反应为:10Na2O2 + 6Al3+ + 6H2O = 4Al(OH)3 + 2AlO-2+ 5O2↑+ 20Na+
考点:结合元素推断考查元素周期表(律)、电子式、化学键,元素及其化合物知识,氧化还原知识。


科目:高中化学 来源: 题型:
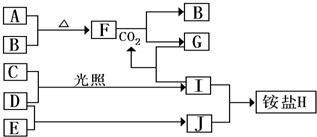
 下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题:
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题:

| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

请按要求完成下列问题:
(1)反应③的化学方程式__________________________________________________。
(2)C的结构式_______________;H的化学式_____________________。
(3)L的溶液与化合物E反应的离子方程式_______________________________________。
(4)化合物J的化学式________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com