
����Ŀ������ӦIO3-+5I-+6H+![]() 3I2+3H2O��Ƴ���ͼ��ʾ��ԭ��ء�
3I2+3H2O��Ƴ���ͼ��ʾ��ԭ��ء�
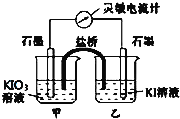
��1����ʼʱ����ձ��м�������Ũ���ᣬ������ָ������ƫת����ʱ�׳��з����ĵ缫��ӦʽΪ____�����������й��ڵ����ƵĶ���������˵����ȷ����____(����)��
a.�����ƶ�����С b.�����ƶ����п��ܱ�Ϊ0
c.�����ƶ���һֱ���� d.�����ƵĶ���������
��2������ڼ�Ũ����ǰ���ס����ձ��ж����������Һ������Һ�������ձ���_______(����������������)��
��3������һ��ʱ���,���������ձ�����ŨNaOH��Һ,��ʱ�ҳ��з����ĵ缫��ӦʽΪ______��������ָ����_______(����������������)ƫת��
���𰸡���1��2IO3��+10e��+12H+ = I2+6H2O��a��b����2���ס��ң���3��I2+2e��= 2I������
��������
���⣨1����ʼʱ����ձ��м�������Ũ���ᣬ������ָ������ƫת�����ݷ���ʽ��֪������õ����ӣ�������ԭ��Ӧ�����ʱ�׳��з����ĵ缫��ӦʽΪ2IO3��+10e��+12H+ = I2+6H2O��a�����ŷ�Ӧ�Ľ��У����ӵ�Ũ����С��������ƶ�����С��a��ȷ��b����Ӧ�ﵽƽ��״̬ʱ�����ƶ�����Ϊ0��b��ȷ���������Ϸ�����֪cd����ѡab��
��2�����е�����ʧȥ����ת��Ϊ���ʵ⣬���е�����õ�����ת��Ϊ���ӵ⣬������������ɫ��������ڼ�Ũ����ǰ���ס����ձ��ж����������Һ����Һ�������ձ��Ǽס��ҡ�
��3������һ��ʱ������������ձ�����ŨNaOH��Һ����ʱ���е�ʧȥ����ת��Ϊ������������Ǹ������ҳ��е�õ�����ת��Ϊ�����ӣ����������������ĵ缫��ӦʽΪI2+2e��= 2I���������������������������ָ������ƫת��


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г���A~XԪ�������ڱ��е�λ�ã���д���пհף�
�� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0�� |
һ | A | |||||||
�� | L | M | Q | |||||
�� | D | G | J | R | X | |||
�� | E | T |
(1)��ЩԪ���У���ѧ������������ǣ�______(������Ԫ�ط��Ż�ѧʽ�Ȼ�ѧ������գ���ͬ)��
(2)������������Ӧ��ˮ�����У�������ǿ�Ļ�������________���û����������ʱ���Ϊ����������������ʷ�Ӧ�����ӷ���ʽΪ__________________________________��
(3)GԪ����TԪ���γɵĻ���������_______(��������������������)�����
(4)D��E��G����Ԫ�ذ�ԭ�Ӱ뾶�ɴ�С��˳������__________________��
(5)AԪ�صĵ��ʷֱ���MԪ�صĵ��ʡ�RԪ�صĵ��ʷ�Ӧ���ɼס��ң��ס��ҳ����¾�Ϊ��̬������������ʱ�ɻ��ϳɱ�����������ĵ���ʽΪ_____________��
(6)RԪ�غ�TԪ�����ߺ˵����֮����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������ͨ©���������( )
A.����������B.������Ȼ�̼C.������Һ����ɳD.���ͺ��Ȼ���ˮ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӱ�컯ѧ��Ӧ���ʵ���������У��϶���ʹ��ѧ��Ӧ���ʼӿ�ķ�����
A. �����¶� B. ������� C. ���ӷ�Ӧ�� D. ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������ȵĹ̶��ݻ����ܱ������У��������淴ӦmA(g) + nB(g) ![]() pC(g) + qD(g)����m��n��p��qΪ��������ʱ����Ӧ�ﵽƽ��ı�־��( )
pC(g) + qD(g)����m��n��p��qΪ��������ʱ����Ӧ�ﵽƽ��ı�־��( )
����ϵ�¶Ȳ��ٸı�
�۸���ֵ�Ũ�Ȳ��ٸı�
�ܸ���ֵ������������ٸı�
�ݷ�Ӧ����v(A)��v(B)��v(C)��v(D)=m��n��p��q
��λʱ����m mol A�ϼ���Ӧ��ͬʱp mol CҲ�ϼ���Ӧ
����ϵ���ܶȲ��ٱ仯
A���ۢܢݢ� B���ڢۢܢ�
C���٢ۢܢ� D���ۢܢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ڿ��淴ӦA2(g)��3B2(g)![]() 2AB3(g)(����Ӧ����)����������������˵����Ӧ�Ѵﻯѧƽ��״̬����
2AB3(g)(����Ӧ����)����������������˵����Ӧ�Ѵﻯѧƽ��״̬����
A�����������ڻ��������ܶȲ��ٱ仯
B��AB 3������������B2����������֮��Ϊ2��3
C����ѹ�����ڻ������������ʵ������ٱ仯
D����λʱ���ڶ���a mol A��A����ͬʱ����6a mol A��B��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������SO2�ͺ�0.7mol�����Ŀ���������CO2������һ��������ܱ������У�550��ʱ���ڴ��������·�����Ӧ��2SO2+O2 ![]() 2SO3������Ӧ���ȣ�����Ӧ�ﵽƽ����������еĻ������ͨ������NaOH��Һ���������������21.28L���ٽ�ʣ������ͨ������ûʳ����ļ�����Һ����O2�����������ּ�����5.6L���������������Ϊ��״���µ��������������������һλС����
2SO3������Ӧ���ȣ�����Ӧ�ﵽƽ����������еĻ������ͨ������NaOH��Һ���������������21.28L���ٽ�ʣ������ͨ������ûʳ����ļ�����Һ����O2�����������ּ�����5.6L���������������Ϊ��״���µ��������������������һλС����
��ش��������⣺
��1���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��______��������ĸ��
a��SO2��SO3Ũ�����
b��SO2�ٷֺ������ֲ���
c�������������ѹǿ����
d��SO3������������SO2�������������
e�������л��������ܶȱ��ֲ���
��2����÷�Ӧ�ﵽƽ��ʱSO2��ת����______���ðٷ�����ʾ������д��������̣�
��3������ƽ���������5%ͨ�������BaCl2��Һ�����ɳ������ٿˣ���д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����������һ�������¾�������ͼ��ʾ��ת����ϵ�������жϴ������

A. ��ͼ�з�Ӧ��Ϊ��������ԭ��Ӧ����WΪһԪǿ��ʱ����Z������NaAlO2
B. ��ͼ�з�Ӧ��Ϊ������ԭ��Ӧ����WΪ�ǽ�������ʱ����Z������CO2
C. ��ͼ�з�Ӧ��Ϊ��������ԭ��Ӧ����WΪһԪǿ��ʱ��X������NH3
D. ��ͼ�з�Ӧ��Ϊ������ԭ��Ӧ����WΪ��������ʱ����Z������FeCl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com