
【题目】下列各组混合物能用普通漏斗分离的是( )
A.柴油与汽油B.碘和四氯化碳C.淀粉溶液和泥沙D.汽油和氯化钠水溶液
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的![]() ,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
(1)B单质的电子式是________。
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为___________________。
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):

(1)A的结构简式为________。
(2)A→B为加成反应,B的结构简式为________。
(3)A→D反应中的试剂②是________。
(4)C和F生成G的化学方程式是________。
(5)满足下列条件的H的同分异构体的结构简式为_________。
a. 属于醇类
b. 核磁共振氢谱除苯环吸收峰外只有2个吸收峰
(6)下列说法正确的是_________。
a. A和HCl反应的产物可合成塑料
b.E中所有的碳原子在同一直线上
c.1mol有机物 H完全燃烧生成7mol H2O
(7)写出由乙炔和乙醇为主要原料(其他无机试剂任选)制备CH3CH2OOCCH2CH2COOCH2CH3的合成路线。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
___________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%(质量分数)乙醇溶液中所含O-H数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应IO3-+5I-+6H+![]() 3I2+3H2O设计成如图所示的原电池。
3I2+3H2O设计成如图所示的原电池。
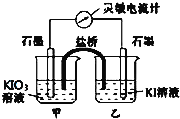
(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,此时甲池中发生的电极反应式为____,工作过程中关于电流计的读数,下列说法正确的是____(填编号)。
a.电流计读数逐渐减小 b.电流计读数有可能变为0
c.电流计读数一直不变 d.电流计的读数逐渐增大
(2)如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,则溶液变蓝的烧杯是_______(填“甲”、“乙”)。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时乙池中发生的电极反应式为______,电流计指针向_______(填“左”、“右”)偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com