
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%(质量分数)乙醇溶液中所含O-H数目为7NA
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。
(1)以下是实验室常用的部分仪器。

①仪器f和j的名称分别为_____、______。
②在分液操作中,必须用到的仪器是_________(填字母,下同)。
③能作反应容器且可直接加热的仪器是_________。
④过滤时,需要用到的玻璃仪器是_________
(2)下列实验操作的叙述中,正确的是______(填字母)。
A.将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.稀释浓硫酸时,可先在烧杯中加入一定体积的浓硫酸,再在搅拌下慢慢加入水
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应(1)是自海藻灰中提取碘的主要反应,反应(2)是自智利硝石中提取碘的主要反应:2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 (1)
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 (2)
下列有关说法正确的是
A. NaI和NaIO3在一定条件下能反应生成I2
B. I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C. 两个反应中生成等量的I2时转移的电子数相等
D. 氧化性:MnO2>IO![]() >I2>SO
>I2>SO![]() >Mn2+
>Mn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
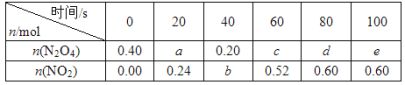
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
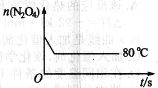
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O![]() 6Cu+SO2↑。下列关于该反应的说法中,正确的是
6Cu+SO2↑。下列关于该反应的说法中,正确的是
A. 每生成22.4L SO2,反应中转移6 mol电子
B. Cu2S在反应中既是氧化剂,又是还原剂
C. Cu既是氧化产物又是还原产物
D. 每生成19.2 g Cu,反应中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
![]()
①上图中的“冷凝物”为________(填化学式)。

②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 molL1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 molL1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___(填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________(列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ molL1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生产、生活的认识错误的是
A. CO2、SO2、N2等均是造成温室效应的气体
B. 节能减排符合低碳经济的要求
C. 使用清洁能源是防止酸雨发生的重要措施之一
D. 大量焚烧田间秸秆会污染空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com