
【题目】有机物H是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):

(1)A的结构简式为________。
(2)A→B为加成反应,B的结构简式为________。
(3)A→D反应中的试剂②是________。
(4)C和F生成G的化学方程式是________。
(5)满足下列条件的H的同分异构体的结构简式为_________。
a. 属于醇类
b. 核磁共振氢谱除苯环吸收峰外只有2个吸收峰
(6)下列说法正确的是_________。
a. A和HCl反应的产物可合成塑料
b.E中所有的碳原子在同一直线上
c.1mol有机物 H完全燃烧生成7mol H2O
(7)写出由乙炔和乙醇为主要原料(其他无机试剂任选)制备CH3CH2OOCCH2CH2COOCH2CH3的合成路线。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
___________________________________________________________________
【答案】 CHCH CH2=CH—CCH CH3Br 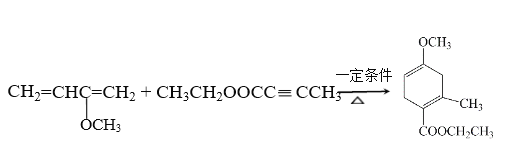
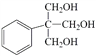 abc
abc 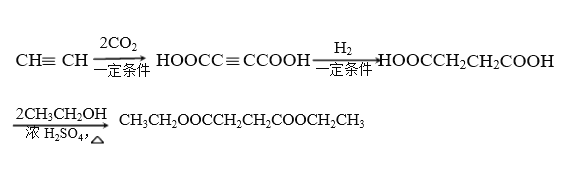
【解析】A→B为加成反应,结合C的结构和信息i可知,B为CH2=CHC≡CH,对比C、G的结构可知,结合信息iii,可知,F为CH3C≡CCOOCH2CH3,则E为CH3C≡CCOOH。
(1)A的分子式为C2H2,为乙炔,结构简式为CHCH,故答案为:CHCH;
(2)根据上述分析,A→B为加成反应,B的结构简式为CH2=CH—CCH,故答案为:CH2=CH—CCH;
(3)根据信息ii和流程图可知,A→D反应中的试剂②为CH3Br,故答案为:CH3Br;
(4)C和F发生加成反应生成G,反应的化学方程式为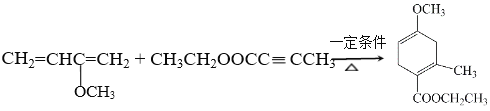 ,故答案为:
,故答案为: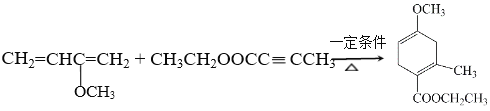 ;
;
(5)H为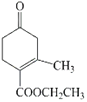 ,a. 属于醇类,说明含有羟基;b. 核磁共振氢谱除苯环吸收峰外只有2个吸收峰,满足条件的H的同分异构体的结构简式为
,a. 属于醇类,说明含有羟基;b. 核磁共振氢谱除苯环吸收峰外只有2个吸收峰,满足条件的H的同分异构体的结构简式为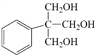 ,故答案为:
,故答案为: ;
;
(6)a. 乙炔和HCl反应可以生成氯乙烯,氯乙烯可通过加聚反应生成聚氯乙烯塑料,故正确;b. E为CH3C≡CCOOH,碳碳三键是直线结构,因此E中所有的碳原子在同一直线上,故正确;c. H为 ,H的分子式为C10H14O2,1mol H完全燃烧生成7mol H2O,故正确;故选abc;
,H的分子式为C10H14O2,1mol H完全燃烧生成7mol H2O,故正确;故选abc;
(7)由乙炔和乙醇为主要原料制备CH3CH2OOCCH2CH2COOCH2CH3。需要有乙醇和HOOCCH2CH2COOH,根据D→E的信息,合成HOOCCH2CH2COOH可以由乙炔与二氧化碳反应生成HOOCC≡CCOOH,再与氢气加成即可,合成路线为CHCH![]() HOOCC≡CCOOH
HOOCC≡CCOOH![]() HOOCCH2CH2COOH
HOOCCH2CH2COOH![]() CH3CH2OOCCH2CH2COOCH2CH3,故答案为:CHCH
CH3CH2OOCCH2CH2COOCH2CH3,故答案为:CHCH![]() HOOCC≡CCOOH
HOOCC≡CCOOH![]() HOOCCH2CH2COOH
HOOCCH2CH2COOH![]() CH3CH2OOCCH2CH2COOCH2CH3。
CH3CH2OOCCH2CH2COOCH2CH3。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是
A.硅可用作半导体材料
B.氯气可用于制取漂白粉
C.二氧化硅可用于制造光导纤维
D.浓硫酸可以干燥NH3、H2等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~X元素在周期表中的位置,填写下列空白:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
一 | A | |||||||
二 | L | M | Q | |||||
三 | D | G | J | R | X | |||
四 | E | T |
(1)这些元素中,化学性质最不活泼的是:______(用具体元素符号或化学式等化学用语填空,下同)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物是________,该化合物与性质表现为两性氢氧化物的物质反应的离子方程式为__________________________________。
(3)G元素与T元素形成的化合物属于_______(填“共价”或“离子”)化合物。
(4)D、E、G三种元素按原子半径由大到小的顺序排列__________________。
(5)A元素的单质分别与M元素的单质、R元素的单质反应生成甲、乙,甲、乙常温下均为气态,且两者相遇时可化合成丙。化合物丙的电子式为_____________。
(6)R元素和T元素两者核电荷数之差是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 用惰性电极电解氯化镁溶液:2Cl+2H2O ![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 将氯化亚铁溶液和稀硝酸混合:3Fe2++NO3 -+4H+=3Fe3++NO↑+2H2O
C. 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++ OH-====NH3·H2O
D. NaAlO2 溶液中通入过量 CO2:2AlO2-+ CO2 + 3H2O === 2Al(OH)3↓ +CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学设计了如下实验流程:在一个小烧杯里,加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如下,回答下列问题:
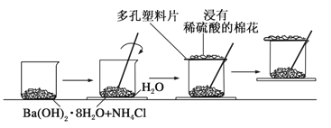
①实验中玻璃棒的作用是_______。
②浸有稀硫酸的棉花的作用是______。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用____能,还能为农业生产提供优良的肥料。已知:标准状况下的112.0LCH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为________。
②如果上述反应生成的是水蒸气,则反应放出的热量___4448kJ。(填“>”或“<”或“=”)
(3)钢铁在潮湿的空气中生锈主要是由电化学腐蚀造成的,发生腐蚀时铁和内部的杂质碳及钢铁表面的电解质溶液形成原电池。钢铁发生吸氧腐蚀时正极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是______。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率______(用百分数表示)。(写出计算过程)
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com